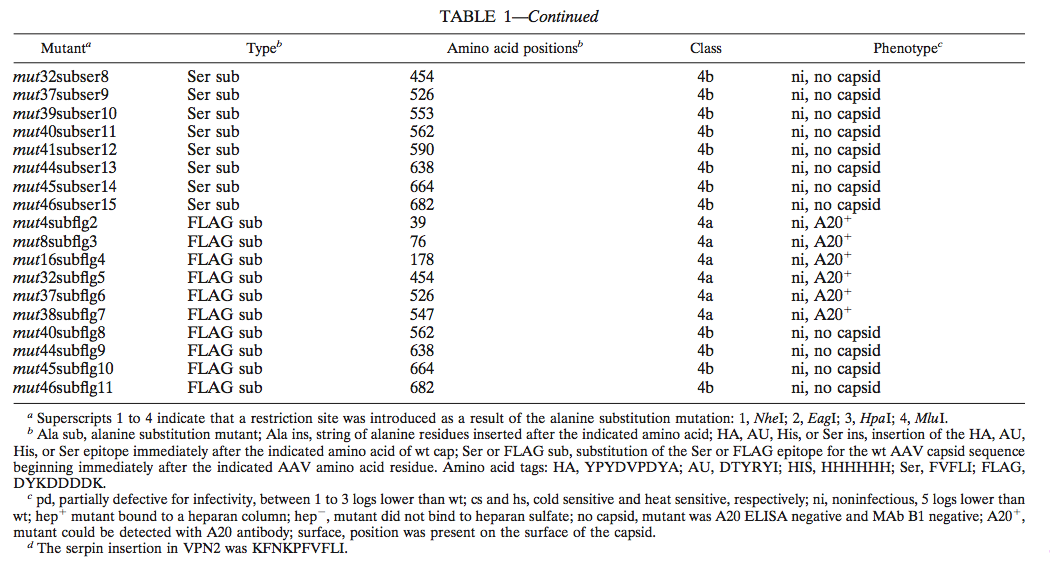
【8.5.2】腺相关病毒2型(AAV2)衣壳基因的突变分析和AAV2载体的构建改变取向
腺病毒相关病毒2型(AAV2)已被证明是基因治疗的有价值载体。 AAV衣壳蛋白的功能结构域的表征可以促进我们对病毒组织趋向性,免疫反应性,病毒进入和DNA包装的理解,所有这些都是产生改善的载体的重要问题。为了获得AAV衣壳基因的全面遗传图谱,我们通过定点诱变在AAV衣壳基因的59个不同位置构建了93个突变体。研究了几种类型的突变体,包括表位标签或配体插入突变体,丙氨酸扫描突变体和表位替代突变体。对这些突变体的分析揭示了八种不同的表型。突变体的传染性滴度(Infectious titers)显示出四个等级:
- 1类突变体是活的(viable),
- 2类突变体是部分缺陷的,
- 3类突变体是温度敏感的,
- 4类突变体是非感染性的。
进一步分析揭示了2,3和4类突变体中的一些缺陷。在4类突变体中,一个子集完全消除了衣壳形成。这些突变体主要但非排他地位于衣壳蛋白VP3中可能是β-barrel结构的位置。这些突变体中的两个是在VP3的N和C末端插入,表明VP3的两端对衣壳组装或稳定性起重要作用。几种2类和3类突变体产生在病毒颗粒纯化过程中不稳定的衣壳。一种突变体R432A仅产生空衣壳,可能是由于包装病毒DNA的缺陷。此外,五种突变体在乙酰肝素结合方面存在缺陷,这一步被认为是病毒进入所必需的。它们分布在衣壳蛋白VP3中可能是细胞表面环的两个氨基酸簇中。第一簇跨越氨基酸509至522;第二个是在氨基酸561和591之间。除了乙酰肝素结合簇之外,血凝素表位标签插入还鉴定了衣壳表面上的几个其他区域。这些包括在氨基酸1,34,138,266,447,591和664处的插入。位置1和138分别是VP1和VP2的N末端;第34位完全属于VP1;剩余的表面位置位于VP3的假定环区域。剩余的突变体,其中大部分是部分缺陷的,可能在病毒进入的步骤中有缺陷,这些步骤未在初步筛选中测试,包括细胞内运输,病毒脱涂或共同受体结合。最后,体外实验表明,在VP1或VP2的N-末端区域插入serpin受体配体可以改变AAV的向性。我们的结果提供了关于AAV衣壳功能结构域的信息,并且可用于未来设计用于靶向特定组织的AAV载体。
hemagglutinin (HA)
一、前言
腺相关病毒2型(AAV2)属于人类细小病毒家族,需要辅助病毒进行生产性复制(5,7,8)。无包膜衣壳采用直径约20 nm的二十面体结构。包装在衣壳内的是4.7kb的单链DNA基因组,其包含两个大的开放阅读框(ORF):rep和cap。称为VP1,VP2和VP3的三种结构蛋白在cap ORF中编码,并通过使用选择性剪接和备选起始密码子由p40启动子制备。这三种蛋白质共享相同的ORF并在相同的终止密码子处结束。所有三种衣壳蛋白共有的C-末端区域折叠成α-桶结构,存在于几种病毒中(31)。它们的分子量为87,73,62kDa,它们在衣壳内的相对丰度约为分别为5,5,90%。最近,AAV作为基因治疗载体引起了极大的兴趣。它具有许多独特的优势,可能对基因治疗应用有用,包括感染非分裂细胞的能力,缺乏致病性,以及建立长期基因表达的能力。
对AAV缺失突变体的早期遗传研究表明,衣壳蛋白是单链DNA积累和感染性颗粒产生所必需的。所有三种蛋白质共有的C末端区域的突变也消除了病毒粒子的形成,并且未能积累单链DNA。 VP1被认为对病毒感染性或稳定性很重要,因为VP1特有的N末端区域的突变产生含DNA的组装研究,衣壳起始密码子诱变研究表明VP2和VP3都是衣壳所必需的。 VP3的核定位需要VP1或VP2的形成和产生。最近,Hoque等人 已经表明,VP2 N-末端残基29-34足以进行核转录,并表明VP2的主要功能是将VP3转移到细胞核中。最近一项关于AAV衣壳蛋白的插入突变研究表明,衣壳基因突变可能影响AAV衣壳组装和感染。由于AAV的晶体结构仍然不可行,AAV衣壳蛋白的功能域主要基于来自其他相关自主细小病毒,犬细小病毒(CPV),猫泛白细胞减少症病毒和B19的信息预测,其晶体结构为可用。 AAV与这些病毒的序列比较揭示了一些保守的功能域,但这些域的确切功能尚不清楚。
虽然某些细胞群不能通过AAV转导,但AAV可以转导多种组织,包括脑,肌肉,肝脏,肺,血管内皮细胞和造血细胞。最近,Summerford和Samulski报道硫酸乙酰肝素蛋白多糖是AAV的主要细胞受体,他们的研究小组进一步发现结合位点位于VP3内。此外,人成纤维细胞生长因子受体1和v5整联蛋白被鉴定为AAV的共同受体。为了扩大AAV的趋向性,也尝试改变AAV衣壳。杨等人通过产生具有针对人CD34蛋白的单链抗体的chi- meric重组AAV(rAAV),显示出改善的造血祖细胞的感染性。 Girod等显示将L14表位插入衣壳编码区可以将该病毒的趋向性扩展到不允许携带L14受体的AAV感染的细胞。然而,在这两种情况下,正常的AAV嗜性都没有被破坏。理想地,为了重新靶向,需要修饰正常的AAV受体结合,使得rAAV仅感染携带工程化表位的受体的靶标。
在这项研究中,我们使用定点诱变来突变衣壳ORF。最初,制备48个丙氨酸扫描突变(alanine scanning mutations ),其中AAV衣壳ORF中的2至5个带电氨基酸通过定点诱变突变为丙氨酸残基。我们推断,由于突变平均间隔15至20个氨基酸(aa)并且跨越整个衣壳基因,它们中的一些将不可避免地落入AAV衣壳的功能结构域中或附近。此外,在寻找可以耐受插入以便重新靶向AAV载体的区域时,进行了超过40个取代和插入突变。通过分析这些突变体,我们获得了AAV衣壳蛋白的初步功能图谱。我们的结果确定了衣壳内的关键区域,这些区域可能负责受体结合,DNA包装,衣壳形成和感染性。此外,我们鉴定了适合表位插入的位点,这些位点可能对靶向基因递送有用。
二、材料和方法
….
三、结果
3.1 产生AAV衣壳突变
我们开始使用丙氨酸扫描定点突变进行研究,希望一些突变体对温度敏感。在非感染性AAV质粒pIM45中构建突变体,其包含除AAV末端重复之外的所有AAV DNA序列。 AAV衣壳基因中有大约60个带电簇。一些簇会重叠;在这些情况下,只选择一个带电簇。对于第一轮诱变,靶向了名为mut1至mut48的48个位点。它们在衣壳基因上大致相等,12个突变体仅在VP1中,5个在VP2中,其余的在VP3中(图1)。除了下面提到的例外,在每个簇中,所有带电荷的氨基酸都转化为丙氨酸。产生突变使得它们还在突变位点含有限制性位点以促进突变序列的确认和随后的外源表位的插入(表1)。此外,在AAV血清型1至6的序列比较后,针对其他几个位置。 mut28和mut35是在AAV4中通过与AAV2的序列比较发现额外氨基酸的位置制备的。 mut32是通过用AAA取代TTT制备的,因为在454位其他AAV血清型中TTT不是保守的。最后,在mut29和mut31中,只有一个Arg残基变为Ala,而在mut45和mut48中,只有一个Lys变为Ala。丙氨酸扫描突变体的位置和特定的氨基酸取代总结在表1和图1中。
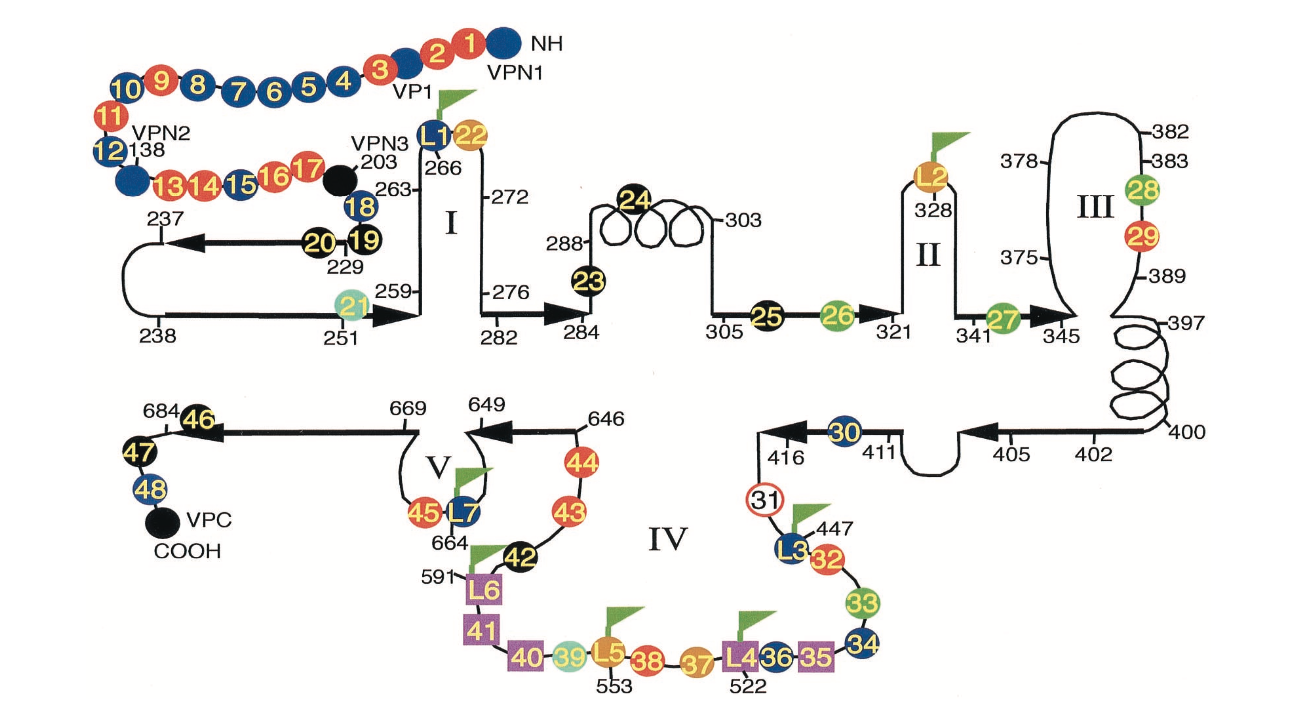
图1.丙氨酸扫描和HA表位插入突变体的分布。 丙氨酸扫描突变体(彩色圆圈或正方形)和HA插入突变体(标记的圆圈或正方形)的位置显示在AAV衣壳蛋白的推定二级结构图上,该结构改编自Chapman和Rossmann对细小病毒衣壳序列的比较。 一些重要的氨基酸位置和突变体位置用短线数字表示。 重箭头代表假定的片段,螺旋代表假定的螺旋。 五个推定的环区域编号为I至V.圆圈的颜色表示突变体的表型,如下所示:

3.2 传染性滴度(Infectious titer)分析揭示了四种一般类型的突变
为了确定每个突变对病毒感染的影响,我们使用wt pIM45或突变pIM45质粒来补充pTRUF5的生长。 pTRUF5是一种重组AAV质粒,含有CMV增强子启动子控制下的gfp基因(22)。得到的重组TRUF5病毒含有wt或突变衣壳蛋白,并且可以通过在Ad5共感染存在下计数绿色荧光细胞来测定感染性。我们之前已经证明,荧光细胞检测产生的滴度是传统感染中心检测结果的两到三倍。最初,使每种突变体在39.5或32℃下生长并滴定,以确定任何突变体是否对温度敏感。实验进行两次,滴度没有显着变化。根据这些滴度,突变体可分为四类(图2;表1)。
- 1类包含具有与wt滴度相似的传染滴度的突变体(小于1个对数差异;例如,mut1和mut2。
- 第2类含有部分缺陷型突变体,其感染性滴度比wt滴度低2至3个对数(例如,mut4和mut5)。
- 第3类包含对温度敏感的突变体;其中三个(mut26,mut27和mut33)是热敏感的,两个(mut28和mut35)是冷敏感的。
- 第4类由12个非感染性突变体组成,其滴度比wt滴度低5个对数级以上。
3.3 非感染性(第4类)突变体和温度敏感(第3类)突变体在包装DNA或形成稳定的病毒颗粒方面存在缺陷。
为了确定不同缺陷型突变体的可能原因,我们首先关注3类和4类突变体。为方便起见,我们忽略了温度敏感突变体在37℃的部分限制温度下生长时具有低感染性的事实(数据未显示),并且在37℃下制备所有3类和4类突变体的病毒制剂。为了确定这些突变体是否能够制备衣壳,我们使用A20 ELISA。 A20抗体仅识别完整的AAV颗粒),无论衣壳是否含有DNA,都可用于测定物理颗粒滴度。通过ELISA读数测试的16个突变体中有8个为阴性,表明它们不能制备衣壳或即使在粗裂解物制剂中也不稳定。所有这些都是4类(非感染性)突变体,并被分类为4b类(表1;图1)。
还对大多数3类和4类突变体进行了QC-PCR测定。 QC-PCR测定法测量含有DNase抗性rAAV基因组的AAV颗粒的滴度(图3)。我们之前已经证明,它提供的物理粒子滴度与通过斑点印迹分析获得的滴度相当,但在低粒子滴度下具有更好的灵敏度(51)。如预期的那样,通过A20 ELISA合成AAV颗粒阴性的突变体也通过QC-PCR测定呈阴性(表2;图3)。对于A20颗粒呈阳性的大多数剩余突变体在QC-PCR测定中对包装的病毒DNA也是阳性的(图3;表2)。这组非感染性突变体(mut22和mut37)被称为4a类(表1;图1)。它们的缺陷不在于包装,而在于病毒进入过程的结合,内化或未涂层步骤。一个A20阳性突变体(mut31)是一个例外,因为它是A20阳性但通过QC-PCR测定DNA阴性。这意味着mut31形成了空的完整病毒颗粒。为了证实这一点,通过EM检查mut31(图4),它确实产生空颗粒。相反,部分缺陷的2类突变体mut4产生类似于wt颗粒的颗粒。 mut31被分配到4c类(图1;表1)。
3.4 一些突变体缺乏结合病毒受体的缺陷
3.5 耐受丙氨酸取代的区域不能耐受其他种类的取代。
3.6 推定的环区域和VP1和VP2的N-末端区域能够接受外来表位的插入
我们还选择了几个其他站点来插入外来序列。 对于这些突变体,我们选择插入较少电荷的HA表位Y PVDVPDYA 。 插入的目标位置是三个衣壳蛋白的VP (VP1,VP2和VP3) N末端区域,cap ORF的C末端和7个位置(突变体L1至L7),他们基于AAV衣壳序列与CPV的比对,认为在衣壳蛋白的环区域中。 由于怀疑这些部位位于衣壳表面,因此在这些部位插入可能不会影响衣壳组装或稳定性(图1)。Girod等人之前成功地将环区域中的突变成功地靶向,,能够在587处插入L14配体而没有显着的感染性损失。
VP1(VPN1)和VP3(VPN3)的N末端和cap ORF(VPC)的C末端的插入不能很好地耐受(表5)。 为了消除这些突变体中的缺陷是由HA标签引起的可能性,其他标签如AU,His和Myc也插入到VP1和VP3的N末端以及帽的C末端,它们也不是 在那些位置安排(表1和数据未显示)。 三个推定的环区域的插入也不可行(表5,突变体L2,L4和L5)。 突变体L4(aa 522)和L5(aa 553)是令人感兴趣的,因为它们产生了显着产量的非感染性物理颗粒。
然而,HA插入在VP1的N末端区域内的aa 34处,在VP2的N末端以及在三个假定的环区域内,环I(突变体L1),环IV(突变体L3和L6),和环V(突变体L7)中被良好耐受。 (表5;图1)。
3.7 一些HA插入位置在衣壳表面上
为了确定HA插入突变体是否含有暴露在衣壳表面上的HA序列,我们使用与HA MAb缀合的珠子的批量免疫沉淀。在每种情况下,通过碘克沙醇密度离心和乙酰肝素柱层析纯化病毒以除去可能存在于粗制病毒制剂中的任何可溶性衣壳蛋白。如所预期的,与wt蛋白pIM45(图6A,B1mAb)相比,在VP2(突变体VPN2)的N末端插入HA标签产生VP2和VP1的分子量的轻微增加。用HA MAb进行蛋白质印迹证实HA标签存在于VP1和VP2中(图6A,HA mAb)。在VP1突变体(在VP1中aa 34处插入HA)的情况下,只有VP1具有更高的分子量,并且只有VP1含有HA标签(图6A),如预期的那样。当用HA MAb缀合的珠子处理活的插入物VPN2(VP2的N末端的HA插入)和VP1(aa 34的插入)时,沉淀了大量的两种病毒(图6B,HA mAb)。这证明在两种情况下HA表位都在病毒颗粒的表面上并且可以被抗体接近。对照wt病毒颗粒(图6B,pIM45)未用HA MAb沉淀至任何显着程度。通过用B1或HA MAb进行Western印迹监测起始材料中的病毒量。
推定的环HA插入突变体L1至L7也与HA MAb缀合的珠一起温育。 尽管这些突变体中的一些突变体产生非感染性病毒,但它们都产生足够的A20抗体阳性病毒颗粒以测试衣壳表面上HA标签的存在。 当这样做时,与wt(pIM45)对照相比,所有L系列插入显示在免疫沉淀物(结合部分)中(图7A)。 这表明在推定的环位点的这些插入中的每一个导致HA表位在衣壳的表面上。
我们还检查了这些环插入是否影响突变体衣壳的乙酰肝素结合。 有趣的是,发现两个环插入突变体L4和L6以较低的亲和力结合乙酰肝素柱(图7B),这可能是标准荧光细胞试验中这些突变体的较低感染性的原因。 L4和L6插入位于heparan结合阴性突变体mut35,mut40和mut41附近(图1)。 所有这五种乙酰肝素结合阴性突变体位于509和591之间,表明AAV衣壳内的该区域构成衣壳蛋白的乙酰肝素结合结构域。
3.8 改变AAV的向性。
为了确定我们是否可以通过在衣壳中插入新的受体配体来改变rAAV的向性,我们构建了两个含有serpin受体配体的突变质粒。在一个案例中,serpin配体FVFLI在aa 34后立即代替AAV衣壳序列。在第二个突变体中,扩增的serpin受体配体KFNKPFVFLI插入VP2的N末端, aa 138(表1)。然后将突变衣壳质粒用于包装CBA-AT,一种rAAV基因组,其含有在杂合CMV-肌动蛋白启动子控制下的hAAT基因。如上所述的HA插入突变体所见,serpin突变体产生rAAV病毒滴度,当通过感染中心测定法在293细胞上滴定时,其感染性略低(6倍)(数据未显示)。然而,当将等量的wt或突变病毒(如在293细胞上测定的)感染到IB3细胞中时,两种突变病毒显示出显着高于wt的感染性(图8)。 VP2 serpin插入的感染性提高了15倍,VP1替换突变体的活性提高了约62倍。这表明IB3细胞,一种被认为表达serpin受体的肺上皮细胞系,是针对丝氨酸蛋白酶抑制标记的嵌合rAAVs比wt更好的靶标,并且突变rAAV的趋向性已经改变。因为两种突变体都保留了wt heparan结合区域,我们还在硫酸乙酰肝素存在下感染IB3细胞,看它们是否继续使用硫酸乙酰肝素蛋白多糖来进入病毒。当这样做时,wt和突变感染性都下降到几乎不可检测的水平(图8)。总之,这些研究结果表明,serpin标记的病毒继续使用硫酸乙酰肝素蛋白多糖作为主要受体,并使用替代的辅助受体,可能是serpin受体。
四、讨论
在本研究中,我们描述了衣壳ORF内59个不同位置的93个AAV2衣壳突变体的表型。 分析了几类突变体,包括表位标签或肽配体插入突变体,丙氨酸扫描突变体和表位替换突变体。 由此,我们可以识别出八种不同的表型(图1;表1)。
4.1 非感染性突变体
大部分非传染性突变体不能组装衣壳或衣壳不稳定。 这些突变体(4b类)主要定位于衣壳蛋白中可能是 - 链结构的但不仅仅是(图1)。 这些突变体中的两个是在VP3的N-和C-末端残基处的插入,表明VP3的两端对衣壳组装或稳定性起重要作用。 我们注意到Ruffing等人先前已经表征了衣壳ORF的C末端的缺失,并且这些缺失也是非感染性的。
一个非感染性突变体mut31产生了空的衣壳。 该突变体由单个氨基酸取代(R432A)组成,显然在包装病毒DNA中存在缺陷,位于假定的环IV中(图1)。 目前尚不清楚病毒DNA包装的机制是什么。 Ruffing等证明空衣壳可以在没有病毒DNA的情况下进行组装。 一些研究表明,包装是一个活跃的过程,需要Rep蛋白与衣壳蛋白的相互作用(42)或可能与DNA复制相结合(49)。 使用mut31的进一步研究可能有助于理解包装机制。
大多数剩余的非感染性突变体(图1,4a类)能够组装衣壳和包装DNA。 这些可能在病毒进入或未涂层的某些方面存在缺陷,需要进一步研究以揭示缺陷的机制。
4.2 受体结合突变体。
两个非感染性mutants,mut40和L4显然是非感染性的,因为它们不能与硫酸乙酰肝素(heparan sulfate)结合(图1,4d级)。硫酸乙酰肝素蛋白多糖被认为是AAV的主要细胞表面受体(37)。另外三种突变体也被鉴定为结合硫酸乙酰肝素的缺陷,两种部分缺陷的突变体(图1,2c类)和一种温度敏感突变体(3b类)。将五个突变体一起分配到环IV中的两个簇中,由40个氨基酸分开。第一个簇跨越509到520(mut35和L4);第二个是在561和591之间(mut40,mut41和L6)。突变体L4和L6由HA表位插入到两个乙酰肝素结合簇中组成。发现它们能够被HA MAb免疫沉淀,证实这些位置在衣壳的表面上。我们还注意到Girod等人报道了在587处插入L14表位,即我们的heparan阴性mut41突变体的位置,能够将病毒靶向L14受体,从而确认该区域位于衣壳的表面上。Rabinowitz等人也报道了一种乙酰肝素阴性插入突变体。 本报告正在准备中;它们一起落在第一簇的522附近。总之,对这些突变体的分析表明,推定的环IV区含有两个位于衣壳表面并参与硫酸乙酰肝素结合的残基。
已经在几种受体和病毒(19a)中鉴定了由XBBBXXBX型(其中B是碱性氨基酸,X是任何氨基酸)的带负电荷的氨基酸簇组成的乙酰肝素结合基序。包含这些簇的区域似乎也对间距变化敏感。虽然在我们的乙酰肝素结合突变体中没有发现这种类似的乙酰肝素结合共有基序,但在这些结构域附近存在碱性氨基酸。 mut35,aa 509处的插入,接近碱性氨基酸K507和H509。有趣的是,K507在AAV1,-2,-3,-4和-6中是保守的,而在AAV5中是K.H509仅存在于AAV2和-3中。已知AAV1,-2和-3与硫酸乙酰肝素结合,而AAV4和-5不与硫酸乙酰肝素结合。另外,在aa 520处插入的L4在碱性氨基酸H526和K527附近,并且在aa 591处插入的L6在R585和R588附近。除AAV4和-5外,H526和K527是保守的,而R585和R588是AAV2独有的。对于所有这些突变体,插入可能破坏了阻碍正常乙酰肝素结合的局部构象。对于mut41,aa 585和588处的R-to-A取代可直接有助于降低的肝素结合。最后,mut40不影响衣壳蛋白中的碱性氨基酸或间距。
4.3 病毒颗粒表面上的衣壳区域。
除了乙酰肝素结合簇之外,衣壳表面还存在其他几个区域。这些包括五个推定的环区域中的四个(突变体L1至L7),VP2的N末端(突变体VPN2),以及氨基酸34(突变体VP1)的VP1的N末端内的区域。在这些位置的HA表位插入都能够用抗HA抗体免疫沉淀(图6和7)。我们注意到aa 266处的L1插入突变体具有部分存活的特殊表型(表1),但是A20 MAb无法检测到,A20 MAb一种识别仅存在于完整病毒颗粒中的构象表位的抗体。由Girod等人在aa 261制备的附近的衣壳形成突变体对A20抗体结合也是阴性的。这表明A20 MAb的至少部分表位由261和266之间的氨基酸组成,并证实该区域位于完整颗粒的表面上。
在被鉴定为位于衣壳表面的位置中,我们发现6个可能接受外来表位或配体插入以将病毒衣壳重新靶向替代受体。这些是VP1的N末端区域(接近aa 34),VP2的N末端(aa 138),环I区域(aa 266),环IV区域(aa 447和591附近),以及环V区(aa 664)。所有这些位置都能够耐受HA(或丝氨酸蛋白酶抑制剂)插入并产生重组病毒滴度,其在wt值的1至2个对数内。此外,在这些位置的HA表位插入能够用抗-HA-HA抗体免疫沉淀(图6和7)。当用serpin配体插入或取代测试时,这些位置中的两个产生的病毒对IB3细胞的感染性比wt病毒高得多。奇怪的是,两种serpin突变体仍然被可溶性硫酸乙酰肝素抑制,这表明硫酸乙酰肝素蛋白多糖仍然是这些突变体的主要受体,并且serpin受体被用作替代的共同受体。可以想象这些衣壳位置中的一个或两个参与与通常充当wt病毒,成纤维细胞生长因子(28)或整联蛋白v5(36)的共同受体的一种或两种蛋白质的结合。这可以解释它们在293细胞上的部分缺陷和IB3细胞的感染性恢复。需要进一步的研究来测试这种可能性。
4.4 具有不稳定衣壳和温度敏感表型的突变体。
发现三种突变体mut21,mut27和mut39具有通过碘克沙醇梯度纯化时不稳定的衣壳。 碘克沙醇是一种等渗的梯度纯化方法,似乎比CsCl离心更温和。 因此,这些突变体似乎对衣壳变性特别敏感。 mut21和mut27在推定的片段中,mut39在环IV中。 值得注意的是Rabinowitz等人。 还在邻近mut21位置的aa 247处分离出不稳定的衣壳突变体,a254。mut27也是在本研究中分离的五种温度敏感突变体之一。 对于识别衣壳组装或感染过程中的步骤,温度敏感突变体和不稳定衣壳突变体应该在将来的研究中证明是有用的。
4.5 可存活和部分缺陷的突变体。
分离的两大类突变体是wt(1类)或部分缺陷(2a类),没有可识别的缺陷(图1)。 1类和2a类突变体均分布在VP1和VP2独特区域或衣壳蛋白的预测环区域( loop regions)中。 我们天真地认为,在替换2到5个丙氨酸残基后产生活菌衣壳的1类突变体位置是对衣壳组装或稳定性不重要的区域,因此应该适应其他类型的取代。 然而,当serpin或FLAG表位在许多这些位点被取代时,大多数突变体是不可存活的,除了VP1中的aa 34。 实际上,许多这些病毒对于衣壳组装是阴性的,并且还应该用于鉴定衣壳组装中可能的中间体。
Ruffing等先前显示VP1和VP2但不包含VP3包含核定位信号(NLS),并且三个推定的NLS位于VP1 / VP2区域中的121至125,141至145和167至171。 Hoque等已经显示aa 167至172足以将VP2靶向细胞核,尽管它们的实验不排除与其他两个推定的NLS序列可能的冗余。在我们的研究中,所有这三个推定的信号都用丙氨酸扫描突变体(mut12,mut13和mut15)进行靶向。其中两个突变体mut12和mut15部分缺陷,NLS的失活可能是其表型的原因。我们注意到mut15应该已经消除了Hoque及其同事发现的NLS。 mut15只是部分缺陷这一事实表明,可能存在一种由Capheid蛋白质使用的替代性冗余NLS序列。第三个突变体(mut13)被归类为存活,但它也显示低于wt滴度(图1)。
4.6 AAV模型的分子计算机图形构建和突变残基的结构定位。
由于AAV晶体结构不可用,CPV VP2(PDB登录号4DPV)的原子坐标使用程序O进行交互式突变,以生成基于同源性的AAV衣壳模型,使用对齐的修改 AAV主要衣壳蛋白(VP3)与CPV的VP2衣壳蛋白。 随着O数据库中标准几何约束的细化,突变随之而来。 该模型提供了一种初步的结构鉴定方法,用于初步结构鉴定表面凹陷(凹坑)中的乙酰肝素受体附着位点,该表面位于衣壳,表面环区域附近,可以容忍外源肽序列插入的表面凹陷,并且可能对 mut31的表型(图9)。

推定的乙酰肝素结合区域的地形位置与已被认为参与宿主细胞因子识别的区域一致,并且与其他细小病毒的组织向性和体内致病性有关。令人感兴趣的是,当AAV VP3序列与CPV VP2序列和大多数其他自主细小病毒序列的VP2进行比较时,推定的乙酰肝素结合位点与AAV衣壳区域相邻,该区域含有肽插入物 。与CPV相比,肽序列的类似插入(尽管不在VP2的同源区域中与AAV中观察到的相同)存在于阿留申貂病病毒和小鼠的微小病毒的衣壳中,靠近凹陷中的残基。抑郁症与组织嗜性有关。因此,这些插入可以是衣壳表面适应,使得衣壳能够在感染期间识别不同的受体。在AAV的情况下,其在其他细小病毒中不存在的凹陷肽插入可以使其识别硫酸乙酰肝素,其未涉及任何其他细小病毒的细胞感染性。
该模型还清楚地表明,耐受HA表位插入的衣壳区域(即,在残基266,447,591和664处)位于β-barrel基序链之间存在的表面环上。 β-barrel基序形成细小病毒衣壳的核心连续壳,而表面环构成表面装饰,决定了成员的菌株特异性生物学特性。 观察到这些表面区域可以抵抗外来肽插入,这表明它们不参与控制衣壳组装的相互作用。
最后,该模型为观察到mut31(R432A)仅能形成空粒子提供了可能的解释。 在未组装的VP3单体中,R432的侧链指向衣壳的内部并且很可能与DNA接触。 如果AAV DNA的识别和包封在最终衣壳组装之前并且涉及寡聚中间体,那么R432与DNA的接触对于启动新生DNA链周围的衣壳组装可能是必需的。
总之,我们已经报道了对AAV2衣壳ORF中59个位点的突变体的初步分析。 我们已经确定了衣壳蛋白中影响感染性,衣壳形成,衣壳稳定性,DNA包装和受体结合的区域。 这些突变体对于定义AAV衣壳蛋白的功能结构域和解剖病毒进入的分子机制应该是有价值的。 另外,我们已经在衣壳基因中定义了许多可以插入外源配体的区域,并且已经证明在这些位置中的一些位置插入外来受体配体可以改变病毒的趋向性。 这是开发下一代AAV载体的第一步,其可以靶向特定的细胞受体或组织。
参考资料
- 2000 . Mutational Analysis of the Adeno-Associated Virus Type 2 (AAV2) Capsid Gene and Construction of AAV2 Vectors with Altered Tropism
