【6.4.1】预测和减少单克隆抗体的聚集
蛋白质聚集(Protein aggregation)仍然是单克隆抗体生产中的主要重点领域。改善抗体的内在特性(intrinsic properties)可以改善可制造性,损耗率,安全性,制剂,滴度,免疫原性和溶解性。在这里,我们基于易于聚集的区域及其对蛋白质热力学稳定性的贡献,探索了预测和降低单克隆抗体聚集倾向的潜力。尽管认为容易发生聚集的区域发生在抗原结合区域中,以驱动与抗原的疏水性结合,但我们能够合理设计变体,显示出明显的聚集倾向降低,同时通过引入人工聚集保守残基(artificial aggregation gatekeeper residues)来保持抗原结合。聚集倾向的减少伴随着表达效价的增加,表明减少蛋白质聚集在整个开发过程中都是有益的。所提供的数据表明,这种方法可以显着减少新型治疗性抗体和蛋白质中的负债(liabilities ),从而导致更有效的临床研究途径。
一、前言
蛋白质颗粒(Protein particles)是由天然和/或变性蛋白质组成的装配体(assemblies )[1],通常对生物制剂的可制造性,稳定性,安全性,效价,免疫原性和溶解性具有负面影响。在这里,我们研究了倾向于β聚集的序列对蛋白质颗粒形成的影响,并仅基于这种结构机制评估了我们预测和抑制抗体颗粒形成的能力。 β-聚集是蛋白质缔合(association )的过程,主要是通过多肽序列的短聚集倾向区域(APR,aggregation-prone regions)形成分子间β-折叠结构[7]。
- 尽管APR本质上大多是疏水性的
- 但它们还需要其他关键特性,例如高β-折叠倾向和低净电荷(a low net charge)。
聚集预测的常见方法是针对在主序列中识别APR。这些预测方法建立了处于未折叠状态的蛋白质的理论聚集潜力,称为“固有聚集倾向”(intrinsic aggregation propensity)。为了使聚集成核,必须将APR暴露在溶剂中才能与其他类似序列形成稳定的相互作用。 然而,在大多数球状蛋白中,这些APR埋在天然结构的疏水核内部,在这里它们被蛋白的热力学稳定性阻止触发聚集。值得注意的例外是APR发生在具有功能重要性的暴露部位,例如蛋白质-蛋白质相互作用界面:此处,该部位的功能要求似乎导致APR的出现,当蛋白质不参与功能相互作用时,这可能是有问题的。因此,蛋白质的有效聚集取决于其中暴露有APR的聚集相容构象的总体。
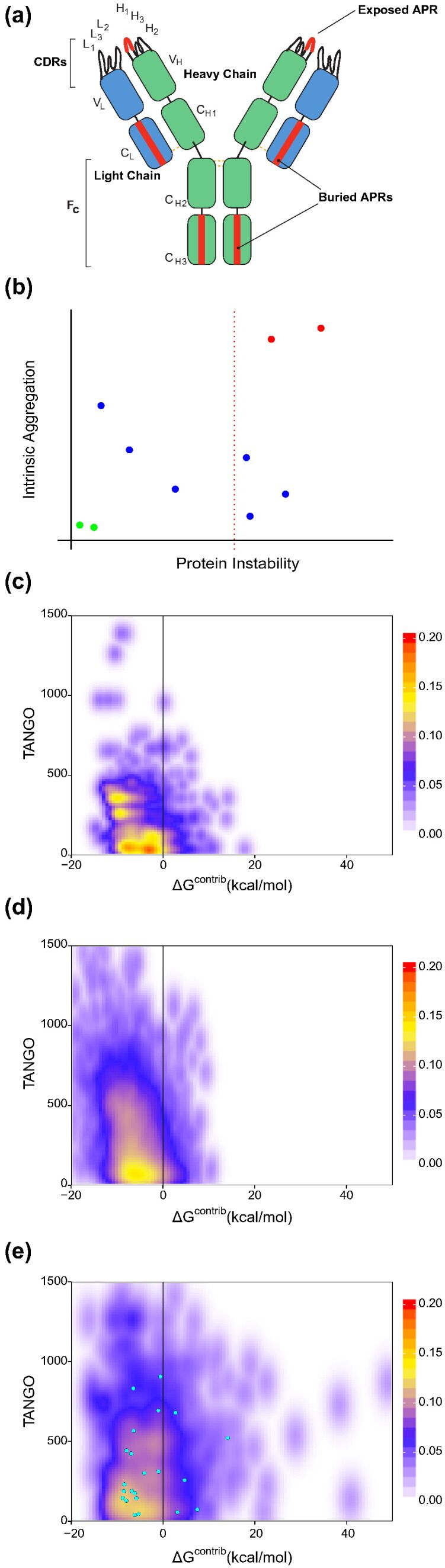
图1 In silico analysis of aggregation propensity in antibody crystal structures. (a) Schematic representation of possible locations of APRs in monoclonal antibodies. APRs in CDRs would be more problematic than APRs buried in the immunoglobulin fold. (b) Stretch-plots: representation of aggregation propensity and local stability of APRs. Problems increase toward the top right of the plot; ideally, APRs would be located in the bottom left. (c) Density plot of all APRs located in the FR of over 2000 antibody structures from the abYsis database [24]. (d) Density plot of aggregation propensity and local stability of APRs in globular protein structures. The analysis is based on a set of 2650 high quality structures (R-factor of < 0.20 and resolution of < 1.9, with 30% sequence identity) of globular proteins generated using the Whatif software suite [25]. (e) Density plot of all APRs overlapping with CDRs of all antibody structure from the abYsis database. Cyan dots: APRs overlapping with CDRs of the 11 model antibodies used in the study.
物理化学参数(例如蛋白质和离子浓度,pH和温度)的相互作用有助于确定蛋白质溶液中易于聚集的构象异构体的浓度。因此,相对较大且热力学稳定的蛋白质(如抗体)面临的挑战是鉴定在天然条件下会聚集的序列。解决此难题的方法在于,APR可以通过折叠进行热力学保护,而后者可以在没有主要展开过渡的情况下形成的具有聚合能力的构象之间进行区分(图1a)。后面的区域将是决定自然条件下聚集倾向的关键APR。先前我们针对保护性抗原和α-半乳糖苷酶证明,这些关键APR中的突变会大大降低蛋白质的总体聚集速率,并增加哺乳动物细胞中可溶性产生的蛋白质的数量。这些突变引入了抑制局部聚集的所谓抑制性网守残基( suppressing gatekeeper residues)[16]。在这里,我们研究了该方法是否可移植到单克隆抗体的工程设计中,考虑到抗体与先前研究的案例之间在结构和大小上的差异,这种方法本身并不重要。此外,我们还想测试该方法是否可以将易于聚集的抗体与较不易于聚集的抗体进行排序,这对于在开发初期对治疗应用的潜在候选者进行优先级排序非常有价值。
我们基于网络的可公开获得的工具[17]假设,结构APR和临界APR之间的区别很大程度上取决于包含APR的区域的局部热力学稳定性。结构性APR有助于蛋白质的稳定性,因此仅在变性时可用于引发聚集,而关键性APR可在自然条件下由于局部结构波动而引发聚集。为了确定热力学稳定性,我们在这里使用经验力场FoldX [18]。 FoldX通过结合所有残基的局部贡献来估算蛋白质结构折叠的自由能,因此,它非常适合评估局部稳定性(此处称为ΔGcontrib,单位为kcal / mol)。为了检测APR的存在,我们使用了统计热力学算法TANGO [19]。 TANGO将APR的固有聚集倾向计算为具有竞争性二级结构趋势(例如α-螺旋或β-发夹结构)的Boltzmann分布。这种实现的好处是,TANGO可以预测具有明确定义的序列边界的APR [20],即APR与周围残基之间的明确分隔。此外,对于我们目前用于识别关键APR的目的特别感兴趣的是,TANGO具有很高的特异性,因此可以预测很少的假阳性APR [8]。开发了其他几个软件包来帮助查找3D结构中的聚集热点[21],[22],[23]。由于这些方法均未同时考虑固有β聚集电势和显式全原子热力学稳定性计算,因此需要将力场(例如FoldX或其他方法)与APR预测方法结合使用,以获得完整的方法。
二、结果
2.1 可视化
为了容易地观察抗体固有的聚集倾向和热力学稳定性,其聚集潜力,我们开发了所谓的“拉伸图”(Stretch-plot)(图1b)。在拉伸图中,每个APR由一个点表示,其纵坐标由序列段的局部聚集倾向(总TANGO,每个残基取值范围5-100)确定,横坐标由其对自由能的贡献确定的折叠度(ΔGcontrib)。从理论上讲,右上角的APR是“关键的”,因为它们出现在蛋白质的不稳定区域中,并显示出较高的固有聚集倾向。为了分析固有聚集倾向与抗体结构的局部热力学稳定性之间的关系,我们从abYsis数据库中分析了2000多种抗体结构[24]。对于这些抗体中的每一种,我们通过确定其APR及其对局部热力学稳定性的贡献来进行延伸图分析。最后,我们将所有2104种抗体的拉伸图结合为热图(图1c和e)。分析清楚地表明,框架区(FR)中的APR在大多数情况下是热力学稳定的,因此得到了很好的保护而不会聚集(图1c)。实际上,抗体FR的拉伸图分布与具有各种结构拓扑的代表性球蛋白的代表性收集图(图1d基于高质量的球形蛋白结构的代表集[25] ])。这种相似性与> 2000 AbYsis抗体结构的互补决定区(CDR)获得的拉伸图分布形成鲜明对比(图1e)。 CDR中的APR显示出更广泛的热力学保护分布,并且其中很大一部分具有高的固有聚集倾向(TANGO)和低的热力学稳定性(FoldX),这使它们在近乎自然的条件下具有聚集能力。为了研究结果是否易受冗余影响,我们使用了不同的序列同一性临界值进行了过滤,这对图的总体分布没有深远的影响(补充图1)。 FR的拉伸图分布与以下观念一致:已进化选择了这些序列以最小化关键APR的发生,而不是在其结构的疏水性核心区域中包含高度稳定的APR。另一方面,CDR是临时选择用于抗原结合的,并清楚地探索了延伸图的更多关键区域。因此,CDR的拉伸图分布表明,由于互补位选择,导致CDR中潜在有问题的APR的出现[3]。确实,对抗体-抗原复合物的分析已经证实,基本上富含APR的芳香族残基(Tyr,Trp和Phe)也大量富含抗体表位[26],[27]。有趣的是,这在蛋白质与蛋白质的相互作用位点中都可以看到[28],而与折叠或家族无关。这就提出了一个问题,即可以选择何种程度的序列来执行特定的高亲和力结合而又不促进相关APR的形成。确定对位的物理化学参数与确定APR的物理化学参数之间的重叠也强调了高度特异性APR预测的重要性,以避免排除假阳性的“关键”抗体。由于聚集是浓度依赖性的过程,因此在高蛋白浓度的条件下,关键的APRs最具挑战性,这不仅发生在治疗制剂中,而且还发生在重组表达过程中的生产细胞中。
2.2 测试集组成和评分功能
为了评估关键CDR相关APR对抗体的溶解度和聚集倾向的影响,我们决定研究11种公开已知抗体序列(mAb1至mAb11;表1)的体外聚集。为了组成这个集合,从abYsis数据库中获取了所有可用的人类序列,并计算了诸如电荷分布,疏水性,统计序列得分[29],CDR特异性属性和聚集趋势(PASTA [30])之类的属性。对于这些特性中的每一个,均获得了分布,并选择了至少一种特性极端且具有X射线结构或紧密同源性建模模板的抗体。例外情况是mAb5(在所有分布中得分均平均),以及由于当时没有X射线结构而随机选择的mAb9和mAb10。所选抗体的CDR中包含APR,这些APR涵盖了密度图分析中的大部分数据(图1e,青色点对应于测试用例中的各个CDR APR)。而且,这些抗体表现出高度多样的延伸图谱,表明某些抗体比其他抗体更易于聚集(图2)。四种抗体在图的问题区域中的CDR中显示APR,即mAb 1、2、5和7。有趣的是,mAb9不符合图1的总体趋势,并且其FR中的APR为热力学稳定性低。其他图(mAb 3、4、6、8、10和11)没有显示出明显的问题。
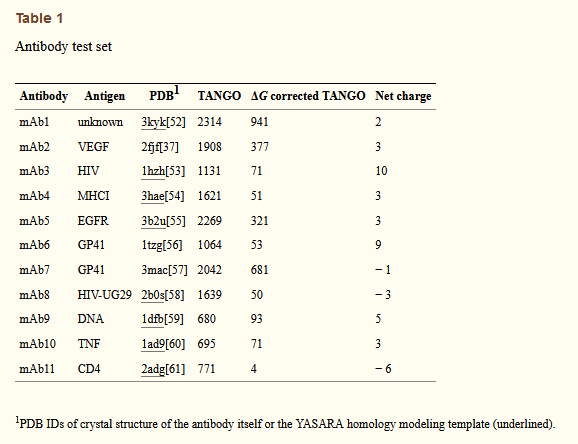
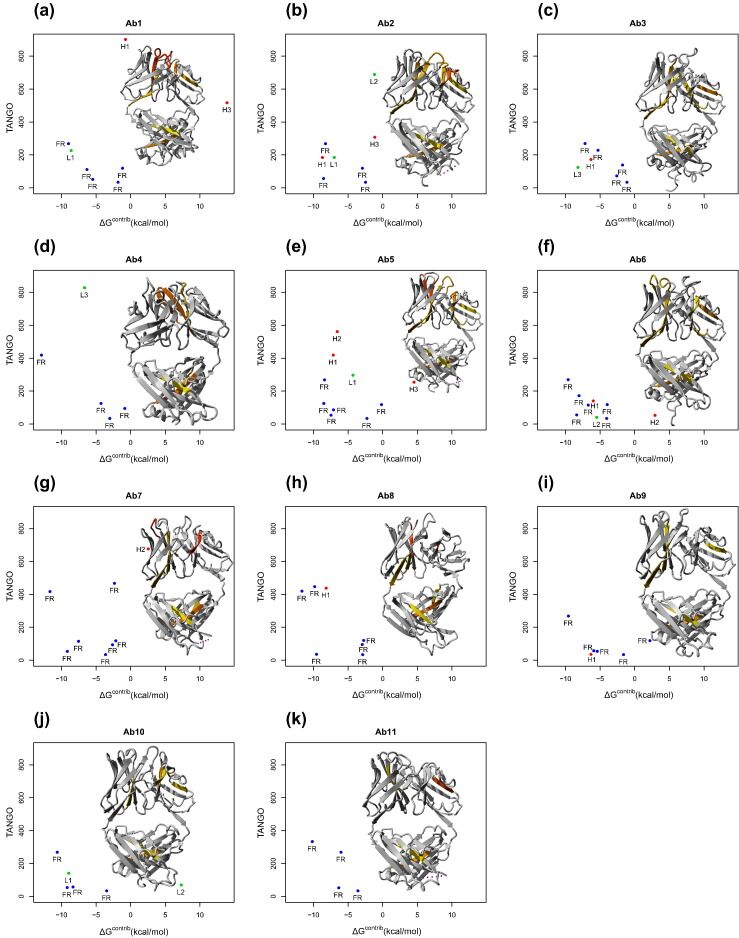
图2 Stretch-plots and schematic representation of the structure of the Fab fragment of the 11 model antibodies used in this study. (a–k) Blue: APRs located in FR of the antibody. Red and green: APRs overlapping with CDRs in the heavy chain (H) or the light chain (L), respectively. Numbers represent CDR number (Chothia numbering) with which the respective APR is overlapping. Colors in structures: yellow: low scoring APR, red: high scoring APR.
为了从每种抗体的拉伸图中提取关键的APR并通过单个指标表示它们,我们开发了一种简单的积分功能。通过在-5和+5 kcal / mol处切断ΔGcontrib并将该值归一化为0和1(0是热力学稳定的APR,1是不稳定的APR)来设计每种APR的校正TANGO得分。将该值与TANGO分数相乘,可以减轻稳定的APR,总分数由关键APR的贡献决定。我们将该评分方案命名为“ Solubis score”,并开始将其与使用我们的11种抗体获得的实验数据进行比较。我们无法从稳定转染的CHO DG44细胞中产生mAb1,并且发现mAb6会片段化。我们通过实验确定了所有剩余抗体的热蛋白解折叠和聚集。通过内在荧光(图3a)监测蛋白质的解折叠,同时使用直角光散射(RALS;图3b)检测聚集[31],[32],分别产生解链温度(Tm)和聚集起始温度(Tagg)。在分析之前,mAb7的大量聚集使我们无法对mAb7进行此分析。其余抗体的Tm对Tagg的关系图(图3c)显示,某些测试的抗体是从天然构象聚集的,即在全局展开过渡之前(Tagg <Tm),而对于其他抗体,聚集开始仅在全局展开时发生(Tagg = Tm)。这就暗示了它们暴露的APR在聚合中起主要作用。重要的是,没有抗体能抵抗超过全局展开过渡的聚集,这与在该组所有抗体的稳定区域中发现的APR的暴露一致(该组中APR总数最低的抗体有四个)。如上所述,图2中的拉伸图分析预测抗体1、2、5、7和9在结构的不稳定区域具有APR,即在天然条件下易于聚集。其中,mAb1无法产生。 mAb7在任何分析之前已聚集;单克隆抗体2、5和9的Tm和Tagg值之间的差异最大(分别为18.9°C,8.5°C和7.6°C)。相比之下,在没有明显APR问题的抗体中,mAb6在生产过程中会显示碎片并必须丢弃,而mAb 4、11和10的Tm与Tagg之间的Tm与Tagg之间的差异小于1度,而抗体3和8则具有中间值(分别为4.6°C和2.8°C)。基于这些观察,对于在伸展曲线中具有关键APR的抗体,似乎有明显的趋势朝着更早的聚集开始。这也可以从Solubis得分与Tm与Tagg之间的差异的图表中看出,再次表明,低分抗体往往具有较小的Tm-Tagg差异(图3d)。尽管我们当前数据集的大小无法得出有关计分方法一般适用性的可靠结论,但这些结果确实表明该方法可以鉴定在天然条件下可驱动抗体聚集的有问题序列。总而言之,TANGO在这些抗体中鉴定出4至10个APR,而Solubis降低为对天然状态聚集至关重要的0、1或2个APR。
图3 Characterization and scoring of the 11 model antibodies. (a) Temperature-dependent evolution of the barycentric mean (BCM) of the fluorescence emission spectrum of three representative antibodies from our test set. Curves were used to derive the melting temperatures (Tm). (b) Temperature-dependent evolution of the RALS intensity measured simultaneously with the data in (a). The aggregation onset temperature Tagg is derived from these data. (c) A plot of the melting points and aggregation onset temperatures of all the test antibodies obtained from stably transfected CHO DG44 cells measured at 0.7 mg/mL. mAb numbers are indicated. (d) Correlation between the Solubis score and the difference between the Tm and the Tagg (ΔTmTagg) for the tested antibodies. (Pearson’s correlation = 0.89, p < 0.02). mAb numbers are indicated. (e) Distribution of Solubis score over the different datasets. 1: WT, 2: FH101P, 3: SL50K, 4: SL50K_FH101P. (f) Stretch-plot summarizing the aggregation propensity and local stability of all APRs identified using TANGO in 27 FDA-approved monoclonal antibodies. Blue: APRs located in the FR of the antibody. Red and green: APRs overlapping with CDRs in the heavy chain (H) or the light chain (L), respectively. Numbers represent CDR number (Chothia numbering) with which the respective APR is overlapping. (g) Receiver operator curve showing the ability of the Solubis scoring function, TANGO, and the number of APRs to classify the WT antibodies structures, based on original crystal structure or homology model built using one template (Table 1). (h) Receiver operator curve similar to (g) but calculated using the results from different homology modeling approaches.
因此,我们将abYsis数据库的Solubis得分与美国食品和药物管理局(FDA)目前批准用于人类治疗的抗体的Solubis得分进行了比较,我们可以找到足够的结构数据(27个序列;图3e和图3 F)。该图描述了abYsis数据库的Solubis得分在0到2500之间,而FDA批准的序列在0到685之间。不到FDA批准的序列中有15%的得分高于300,这在我们的数据集中显然与聚合相关。根据我们的评分,FDA批准的抗体并未完全缺乏暴露的易于聚集的序列,这可能表明我们的评分过于严格。但是,配制FDA批准的抗体时,可以优化产品的稳定性并最大程度地减少聚集,而我们的九种mAb测试套件是在水溶液中制备的,没有任何稳定剂。具有中等聚集倾向的抗体可以满足安全性和功效要求的事实表明,可以朝着有利的化学,制造和控制特性特别改进抗体的选择。
2.5 突变对效价和聚集的影响 Effect of mutation on titer and aggregation
从野生型mAb2旁边的瞬时转染的CHO K1细胞中重组生产并纯化选择用于分析的突变体(列于表2)。突变体和野生型的固有荧光发射和CD光谱的比较证实,突变不会引起抗体总体结构的重大改变(图6a–c)。相反,我们观察到突变体的聚集起始温度有重大改善(图6d)。突变体的Tm与其Tagg的关系图表明,几个单个突变改善了聚集起始温度,而没有降低蛋白质的热力学稳定性(图6e)。使用APR抑制突变获得了Tagg的最强改进,其中轻链中的S50K和重链中的FH101P表现最好,而它们的组合在该图中总体上是最好的突变体。这两个突变的组合(图6e中的变量8)完全消除了mAb2的APR驱动的天然状态聚集。 mAb2的变体8和9显示Tagg改变了15°C,因此Tagg现在等于Tm,并且它们的聚集仅在抗体整体展开时才开始。净电荷增加的突变除了引起APR的影响外,没有引起更多的进一步改善(参见图6e中的变体7和9)。有趣的是,聚集倾向的降低与相同突变体表达滴度的增加有关(图6f)。变体8的表达效价比野生型mAb2高4.5倍,对于变体9是6倍。对于两种变体,净电荷增加突变在表达效价方面具有附加作用。 (图6f)。通过动态光散射和透射电子显微镜(补充图2和图3)证实,蛋白库中聚集体的存在减少,进一步证实了这些Solubis设计的突变体的改善的理化性质。此外,尺寸排阻色谱法(SEC)显示纯化后立即测定的单体含量有所增加(补充图4),所有这些都表明这种改善是实质性的,并且可以使用正交方法检测到。
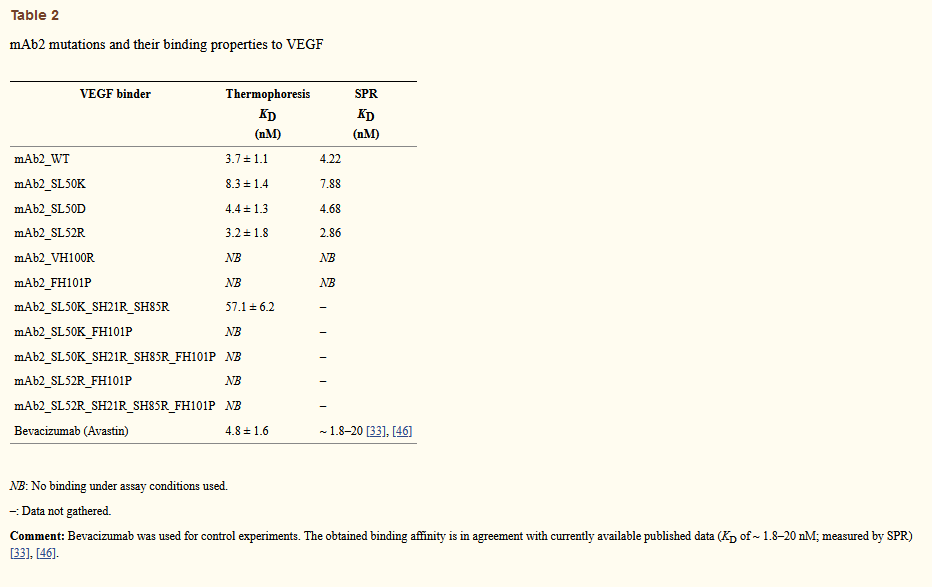
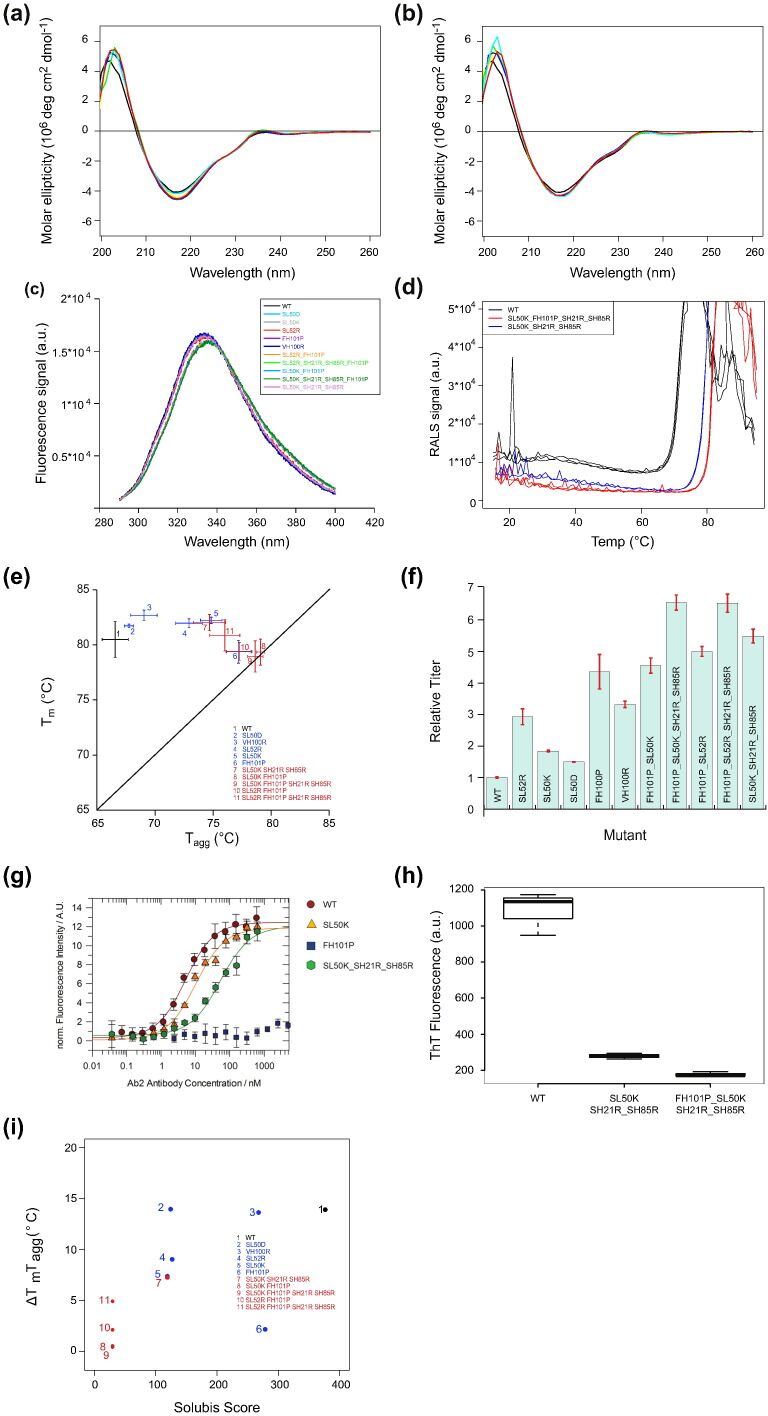
图6 Characterization of mAb2 mutants. (a) Far-UV CD spectra. Black: Wild-type, yellow: SL50K, green: SL50D, blue: FH101P, cyan: VH100R, red: SL52R. (b) Far-UV CD Spectra. Black: Wild-type, yellow: SL52R_FH101P, green: SL52R_SH21R_SH85R_FH101P, blue: SL50K_FH101P, cyan: SL50K_SH21R_SH85R_FH101P, red: SL50K_SH21R_SH85R. (c) Intrinsic fluorescence emission spectra upon excitation at 20 °C of mAb2 and indicated mutants. (d) Temperature-dependent evolution of the RALS intensity for wild-type and two mutants. (e) Aggregation onset points and melting temperatures of wild-type and mutants at 1 mg/mL, obtained from transiently transfected CHO K1 cells. (f) Expression titers for mAb2 wild-type and mutants. (g) VEGF binding determination using optical laser-induced thermophoresis of mAb2 WT and selected mutants. (h) Fluorescence intensity of the rotor dye Thioflavin-T in the presence of mAb2 WT and the mutants SL50K_SH21R_SH85R and FH101P_SL50K_SH21R_SH85R. Excitation was at 440 nm, emission was recorded at 480 nm. (i) Correlation between the Solubis score and the difference between the Tm and the Tagg (ΔTmTagg) for mAb2 wild-type and mutant; numbers are indicated.
2.6 重叠与互补位结合 Overlap with paratope binding requirements
这些数据表明,关键的APR是抗体聚集和表达效价的强力决定因素,因为对此类区域的突变抑制可导致两种特性的显着改善。但是,互补位和APR的重叠物理化学要求都富含疏水/芳族残基,很可能会导致配体结合和聚集倾向之间的权衡。为了测试mAb2变体仍然结合其配体的能力,我们进行了野生型mAb2及其变体及其天然抗原人血管上皮生长因子的表面等离振子共振(SPR)和微尺度热泳结合实验(图6g和表2)。我们发现,在mAb2轻链中掺入取代的变体仍可以结合人类血管上皮生长因子,其亲和力与野生型相当。另一方面,重链APR中最佳的减少聚集的突变FH101P导致抗原结合的完全丧失,这与重链CDR3对于抗原识别的已知重要性相一致[37]。因此,考虑到配体结合和聚集倾向,最成功的mAb2变体(Variant 7)的Solubis得分为120,Tagg改善了8°C,并且表达效价比野生型提高了500%以上类型。通过透射电子显微镜(补充图3)观察到,储备液(在4°C下储存)中不存在聚集体,并且与转子染料Thioflavin-T的结合减少,实验证实了mAb2 SL50K_SH21R_SH85R变体的有利特性。 (图6h)。我们还通过在40°C下180天的长期稳定性研究(表3)证实了mAb2 SL50K_SH21R_SH85R变体的改进。与野生型相比,该变体在t = 0时显示较少的聚集,并且随着时间的推移单体含量的下降较慢。

三、讨论
总之,我们开发了一种评分方案,该方案确定了天然条件下抗体聚集的风险。我们的算法不仅考虑了一级抗体序列的固有聚集倾向,而且考虑了这些易于聚集的序列嵌入其中的结构背景。因此,从抗体一级序列中的全套APR开始,评分功能可识别出在天然条件下最有可能实际触发完全折叠的蛋白质发生聚集的蛋白质。在我们的11种抗体测试集中,不同抗体的一级序列中的APR总数在4到10个APR之间。但是,只有在多肽的完全展开和延伸状态下,所有这些APR才可用于聚集。
在抗体中,就像在任何球状蛋白质中一样,大多数APR将被埋在蛋白质的疏水核心中,在那里它们将有助于热力学稳定蛋白质的三级相互作用。这也意味着这些APR通过参与本机交互来避免聚集。这些交互越稳定,这种保护就越有效。因此,我们的算法通过APR对天然蛋白质的热力学稳定性的贡献来对其进行过滤。在我们的11种抗体测试集中,此过滤将每个抗体的相关APR数量降低到零,一个或两个APR(即关键APR)。仅基于这些关键的APR,该方案使我们能够将有限组中的抗体正确分类为具有天然构象风险的抗体和仅在其整体变性的风险的抗体(例如melt upon heating)。当然,考虑到抗体的规范结构,绝大多数的关键APR将成为CDR的一部分。为了证明通过我们的方法预测的关键APR确实负责天然状态的聚集,我们重新设计了易于聚集的抗体2,该抗体可导致突变体的天然聚集减少而不会消除表位结合。有趣的是,我们发现这些相同的突变还可以将抗体的表达效价提高至最佳变体的4.5倍以上。这些结果证明了β-聚集对于单克隆抗体的化学,制造和控制特性的重要性,以及鉴定CDR内的关键APR的重要性。
2.3 坚固性 Robustness
基于结构的评分功能取决于晶体结构或合适的同源性模型的质量和准确性。在早期开发过程中,大多数情况下都无法获得晶体结构。但是,可靠的同源性模型也可以用作结构基础。结构质量和准确性是先决条件,因为评分取决于FoldX对ΔGcontrib的计算。由于此值用于校正原始TANGO分数,因此对Solubis分数具有深远的影响。尽管抗体支架中存在高度的结构保守性,但是显式全原子力场计算的一个特殊问题是它们对原子坐标中相对较小的误差非常敏感。因此,为了评估建模算法对测试集评分的影响,我们希望分析构建同源模型对我们的预测的不同方法的影响。因此,我们使用了软件程序YASARA [35]和MOE [36]。对于MOE,我们准备了带有或不带有附加能量最小化(energy minimization)步骤的模型结构。
为了便于在这些不同模型之间进行比较,我们需要一种方法来评估我们的评分功能在对易溶性抗体的易聚集性进行分类中的性能。为此,我们从分析中丢弃了单克隆抗体1和6,并将其余序列分为易于发生聚集的高和低聚集。由于我们的数据集太小而无法明确地解决 twilight zone,因此我们将临界值任意放置在5°C的Tm-Tagg中,并将mAb7包括在容易发生聚集的类别中。尽管这对于我们的方法显然很讨人喜欢,但是这种分类确实使我们能够轻松地发现建模方法对预测成功的负面影响。可以通过接收器操作员曲线来可视化分类任务的预测性能,该曲线针对关键APR的Solubis评分函数的每个临界值绘制正确预测的比例与假阳性预测的比例(图3g)。随机计分函数通常会针对每个正确的预测显示错误的预测,因此,其轨迹将位于对角线附近。相比之下,从原始结构计算出的Solubis得分位于曲线的左上角曲线上,这意味着该功能可以以最高的灵敏度(零假阴性为零)。率)和高特异性(假阳性率为零)标记此小集合中易于聚集的抗体。在这组抗体中,我们知道哪种抗体容易发生聚集并将其分类,因此Solubis评分明显优于简单的评分方案,例如总原始TANGO评分或由TANGO在序列中鉴定的APR数量。为了完整起见,对于YASARA模型和MOE模型,马修斯相关系数为0.83,曲线下面积为0.93,具有额外的能量最小化步骤。尽管每种方法所获得的分数之间存在一些差异,但是所有抗体的总体评分仍然非常相似,而对预测性能的影响却很小,这可以通过比较不同建模方法的接收者操作符曲线(图3h)显而易见。该结果表明,最新建模引擎的准确性允许以相似的置信度识别关键APR。
2.3 通过抑制突变APR减少聚集
为了进一步证明关键APR的相关性,我们决定采用相同的计算方法来选择预测可抑制APR的突变,并研究其对抗体产生和聚集的影响。为此,我们专注于mAb2 {Protein Data Bank(PDB)ID 2FJF [33]},其Solubis评分为407,在天然条件下显示出明显的蛋白质聚集,但仍可以以合理的产量表达和纯化蛋白质。实际上,mAb2的Tagg间隙低且Tagg-Tm间隙大(图3c)表明该抗体特别容易从天然状态聚集。先前的工作表明,可以通过引入与聚集相对的特定残基来降低聚集倾向,这些残基称为聚集网守( aggregation gatekeepers)[10],[16],[34]。这些残基是带电荷的残基(天冬氨酸,谷氨酸,精氨酸或赖氨酸)或脯氨酸残基,其强烈不利于β链构象。 mAb2的延伸图揭示了分别位于CDR L2和H3中的两个关键APR的身份(图2b和and4a4a和b)。为了确定可降低这些APR固有内在聚集倾向而又不降低其对抗体热力学稳定性贡献的突变,我们计算了对APR残基向网守的每个突变对聚集倾向和蛋白质稳定性的影响(即五个突变) (APR中的每个位置),并生成了所谓的突变体聚集和稳定性谱(MASS)图[35](图4c和d)。在MASS图中,每个突变均表示为一个点,其纵坐标由与突变相关的内在聚集倾向(TANGO)的变化确定,横坐标由ΔΔG确定,即热力学稳定性的变化(FoldX)。使用这种方法,我们鉴定并选择了预计可最大程度降低mAb2 CDR中关键APR的聚集倾向的突变,而对蛋白质稳定性的不利影响最小。从L2的55个可能的突变中,我们选择SL50K,SL52R和SL50D进行进一步评估,从H3的65个计算出的突变中,我们选择FH101P和VH100R(图4c,d和e)。预测这些突变将使APR较少易于聚集,而不会在本地和全球范围内过多地破坏蛋白质的稳定性。
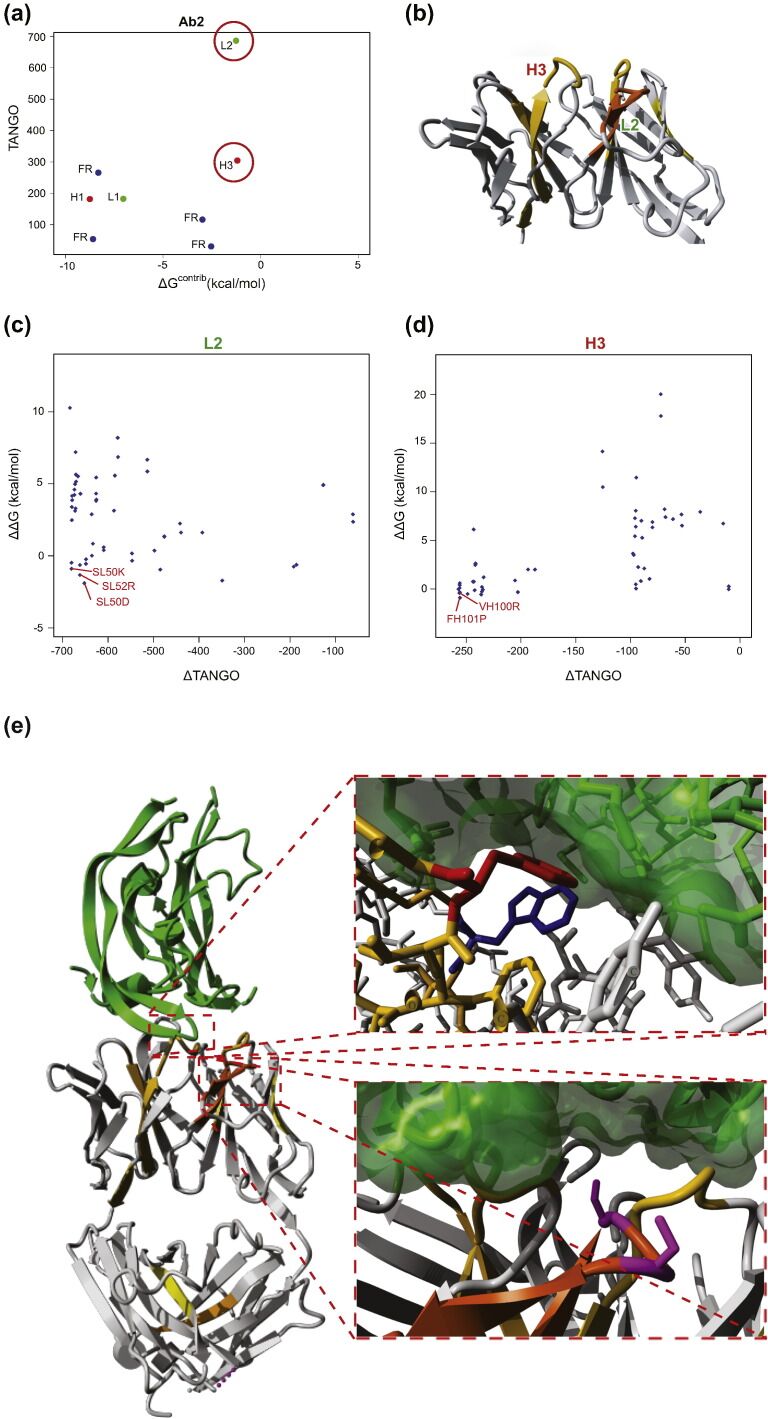
图4 Design of APR disrupting mutations. (a) Stretch-plot of mAb2; critical APRs are highlighted with red circles. (b) Crystal structure of the variable domain of mAb2 with the APRs highlighted. (c–d) MASS plots of the two critical APRs in mAb2 with mutation effects on aggregation propensity and stability. Chosen mutations are highlighted in red. (e) Left: Crystal structure of mAb2 in complex with VEGF. Gray: mAb2, green: VEGF. Top right: Zoom on the APR in the heavy chain. Red: FH101, blue: Tryptophan located close to FH101, green: VEGF with molecular surface displayed. Bottom right: Zoom on the APR in the light chain. Magenta: SL50 and SL52, green: VEGF with molecular surface displayed. Images were made using YASARA Structure.
2.4 通过增加净电荷来改善胶体稳定性 Improving colloidal stability through net charge increases
鉴于抗原结合决定簇和聚集之间存在明显的重叠,我们决定通过引入具有抑制作用的关守者( suppressing gatekeepers )(其作用于蛋白质的整体净电荷)来直接破坏关键APR的突变。尽管这不能消除分子固有的聚集潜力,但至少会增加其胶体稳定性,从而降低启动蛋白质聚集所需的初始缔合[36]。此外,APR破坏可能显示出与净电荷的相互作用,正如在保护性抗原的工程中所观察到的那样[16],我们注意到增加蛋白质净电荷的把关者(gatekeeper )在减少聚集方面也表现最佳。此外,对于绿色荧光蛋白,先前已证明极端增压可有效抑制聚集,但出于免疫原性考虑,这可能不是治疗分子的选择[36]。众所周知,重链CDR 3通常对于抗原结合至关重要,我们发现直接APR破坏最有可能影响结合亲和力。因此,我们着手测试通过使重链增压而起作用的替代突变。为此,我们使用FoldX计算每个增加CDR外重链净电荷的突变的ΔΔG值,在mAb2重链的情况下,其为正值(+ 2)。这产生了627个潜在的突变(图5a),从中我们从重链中选择了另外两个突变,即SH21R(ΔΔG=-1.2 kcal / mol)和SH85R(ΔΔG=-1.2 kcal / mol;图5a和b )。将这些突变与轻链APR破坏突变SL50K和SL50R结合在一起,以查看净电荷增加是否可以在重链中发挥APR破坏的作用。此外,我们还向重链和轻链APR干扰物的组合中添加了净电荷突变,从而产生了表2中所示的一组突变。
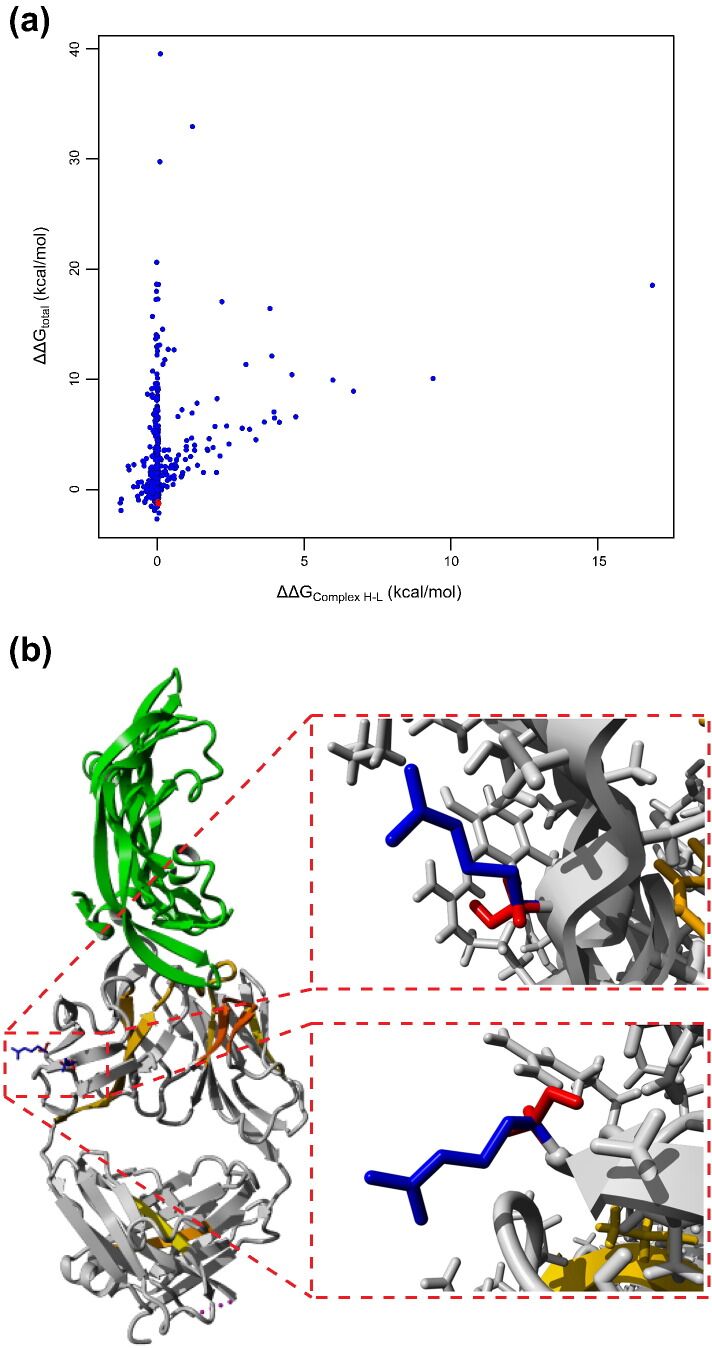
图5 Design of net charge increasing mutation in the heavy chain. (a) Effect of all mutations on the global stability (ΔG) and stability of the complex between the heavy and light chain. Blue: Mutations that were not selected. Red: Selected mutations. (b) Left: Crystal structure of mAb2 in complex with VEGF. Gray: mAb2, green: VEGF. Top right: Zoom on the net charge increasing mutation SH21R. Red: SH21, blue: RH21. Bottom right: Zoom on the net charge increasing mutation SH85R. Red: SH85, blue: RH85. Images were made using YASARA Structure.
表位结合和抗体的聚集潜力之间的重叠是关键点。确实,如上所述,发生在蛋白质恒定区的APR通常被掩埋在免疫球蛋白结构域之一的疏水核心中,因此对天然态聚集倾向的贡献很小。因此,我们的计分方案的简单替代方法可能是使用CDR的TANGO评分来评估抗体的聚集倾向,实际上,在我们的测试集中,这种方法相当有效:只有mAb4被错误地分类为聚集-易于。该抗体在轻链的CDR环3中具有很强的APR,但由于此环已稳定整合到该抗体的折叠中,因此在天然条件下,该环的存在不会导致强烈的聚集倾向。因此,尽管需要更大的数据集来确定哪种方法更准确,但我们的数据表明,对整个结构上下文的考虑将更加具体。
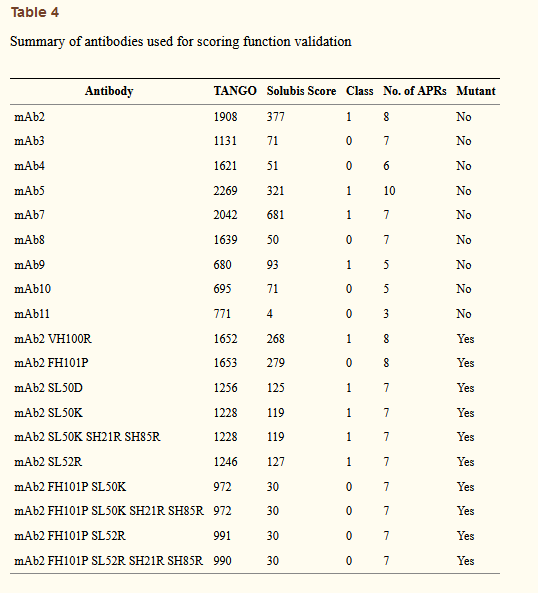
有人可能会说,在对抗体进行分类时,总的TANGO得分(不受结构背景的限制)是一种比Solubis得分更简单的方法。通过这种方法,有问题的抗体中关键APR的存在然后简单地在恒定或高度相似的框架序列中相同APR的总和上加起来,因此倾向于与更高的TANGO总得分相关。在对易于凝集的抗体进行分类时,Solubis评分明显优于野生型抗体的总体TANGO评分(图3g和表4)。同样,有趣的是,抗体中APR的数量没有太多的预测能力,而关键APR的数量是一种有力的方法。当查看Solubis分数是否与mAb2野生型和突变体的Tm-Tagg缺口相关时,我们可以看到一个明显的趋势,但是突变体FH101P对Tm-Tagg缺口的影响比从Solubis分数所预期的要大(图6i和表4)。此外,突变体SL50D对Solubis得分有实质性影响,但不影响Tm-Tagg缺口。有趣的是,与野生型相比,这是一种降低净电荷的突变,表明该因素可能需要纳入我们计分方案的未来改进中。尽管我们的数据集可能太小而无法确定最佳的评分方案,但是很明显,识别关键APR的方法在当前集合上具有最佳的预测能力,同时,还可以识别蛋白质可能从工程学中受益的位点。
在分析了2000多个抗体结构后,我们发现其中大部分具有具有关键聚集倾向的CDR。实际上,表位结合对互补位施加了特定的序列要求,例如对芳香族序列的偏向,这也将有助于聚集。与免疫球蛋白折叠核心的APR相反,CDR中的APR并非针对结构而是针对结合而选择。结果,这些APR通常不会显着促进蛋白质的热力学稳定性,因此即使抗体正确折叠也能促进聚集。
将FDA批准的抗体的聚集倾向与2000多种抗体的abYsis集进行比较,清楚地表明,具有极高Solubis评分的CDR不具备允许商业开发的要求。有趣的是,这里分析的大约15%的FDA批准的抗体仍具有至少一种关键的APR。这表明抗体制剂是稳定单克隆抗体的有效方法,单克隆抗体可能部分通过帮助保护关键APR使其免于聚集而发挥作用。但是,我们的结果还表明,通过开发中的设计和风险管理,在质量方面,鉴定关键的APR可以进一步支持候选抗体的选择。
四、材料和方法
4.1 数据库检索
使用PDB作为数据源,查询了所有Abssis数据库[24],所有生物均排除了带有警告的序列,并排除了未分类,未配对和未编号的序列。 这产生了2561个抗体结构。 删除重复项,下载后还包含错误的抗体也将被删除,从而形成2104个抗体结构的数据库。 使用CD-HIT网络服务器使用0.95和0.90的序列同一性临界值去除了冗余[42]。
从 http://swift.cmbi.ru.nl/gv/select/ 获得具有球形蛋白代表性PDB结构的WHATIF剔除数据集。 对于R因子<0.20和分辨率<2.5Å的结构,以30%序列同一性剔除数据集[25]。
4.2 从abYsis数据库中选择11种公开可用的抗体
获取了abYsis数据库中所有可用的人类序列,并计算了诸如电荷分布,疏水性,统计序列得分[29],CDR特异性属性和聚集趋势(PASTA [30])之类的属性。 对于这些特性中的每一个,均获得了分布,并选择了至少一种特性极端且具有可用X射线结构的抗体。 例外的是mAb5(在所有分布中得分均平均),以及mAb9和mAb10(它们是随机选择的,并且没有X射线结构)。
4.3 同源建模
使用MOE 2015.10(加拿大蒙特利尔的Chemical Computing Group Inc.)的“ Antibody Modeler”应用程序进行同源性建模。该应用程序已按照手册中描述的程序完全自动化运行。但是,排除了与测试mAb的可用晶体结构相对应的模板。侧链碰撞能量截止值设置为1.5 kcal / mol,中间体以“medium”设置进行精制,最终模型以“fine”设置进行精制。使用GB / VI评分,并使用Amber10:EHT(R场)力场进行能量最小化。
在另一种方法中,在同源性建模之后执行了额外的能量最小化步骤(力场:Amber10:EHT; R场1:80;截止(8.10);均方根梯度为0.1 kcal / mol / A2)。
使用YASARA Structure(hm_build.mcr)提供的同源性建模宏,对YASARA进行同源性建模。使用标准设置,并且仅提供每个mAb Fv域异二聚体的FASTA序列。
4.4 计算机分析
将以下方法用于所分析的每种抗体结构。在默认设置下,使用TANGO [19]识别了APR,并使用Chothia规范编号方案[38]定义了位置。清洗所有结构并准备使用YASARA结构[39]进行分析,然后使用FoldX力场对其进行修复[18]。对于所有修复的结构,都使用FoldX运行SequenceDetail命令。使用Python脚本从SequenceDetail文件中检索每个APR的总ΔG。 R-Studio [40]分别使用ggplot2软件包[46]的plot函数和stat_density2d函数的密度图进行了拉伸绘图。总的ΔG值在-5和5kcal / mol之间截止。该值在0到1之间缩放,然后用该值缩放所有TANGO得分,得出APR的ΔG值总和为− 5并降低0。对于每种抗体,将所有APR得分相加,得出在评分功能定义的分数中。
4.4 蛋白质生产和纯化
合成mAb候选物的可变区,并将插入片段克隆到已经包含IgG1同种型恒定区的表达载体中。重链(HC)和轻链(LC)被克隆到单个表达载体中并被共转染。
在第3天和第6天,使用CD EfficientFeed C(Life Technologies),在含有10%推注饲料的CD-OptiCHO中10天补料分批培养的CHO DG44细胞稳定克隆中产生野生型mAb [41]。
mAb2变体通过在CHO K1悬浮液适应细胞中瞬时表达而产生。种子在优化,化学成分确定,无动物成分和无血清的培养基中生长。用专有的转染剂转染细胞。转染后,将细胞在具有专有配方的优化培养基中于37°C和5%CO2下生长8天。
通过蛋白A亲和色谱法(MabSelect或rProtein A Sepharose,GE Healthcare)从细胞培养上清液中纯化蛋白。通过还原和非还原SDS-PAGE分析纯化的mAb。通过SEC对mAb聚集/片段进行定量。
4.4 Production mAb2 variants
4.5 Target binding determination using optical laser-induced thermophoresis
4.6 Determination of melting point (Tm) and aggregation onset temperatures (Tagg)
4.7 CD
具有珀耳帖温度控制系统的J-1500-150ST(Jasco)CD光谱仪用于收集CD光谱。 所有测量均在25°C的190至260 nm之间以1 nm的间距在50 nm min-1的扫描速度,4 s的响应时间,2 nm的缝隙宽度和标准灵敏度下进行。
4.8 Long-term storage stability/SEC
4.9 Electron microscopy
4.10 SPR
参考资料
- J Mol Biol. 2017 Apr 21; 429(8): 1244–1261. doi: 10.1016/j.jmb.2017.03.014: 10.1016/j.jmb.2017.03.014 。Prediction and Reduction of the Aggregation of Monoclonal Antibodies. 链接: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397608/?report=printable
