【2.2.4】抗体药物的成药性
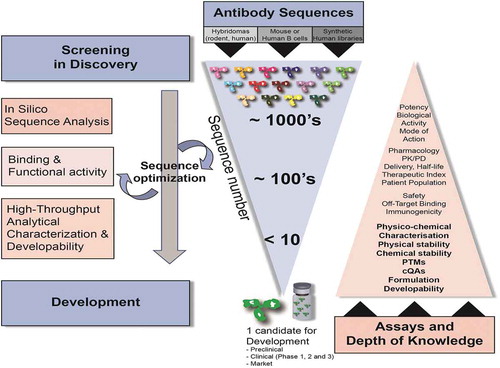
但凡一种药品,必须满足三个要素,安全、有效、质量可控。此外药品也是特殊的商品,也需要追求经济价值,因而在药物开发时,成本效益也是不容忽视的。
抗体药物也属于治疗性药品,因而也需要满足上述要素。受限于资源、成本、时间,往往只有一到两个最终的分子可以推到后续的工艺开发和临床试验,为了进一步降低后期工艺开发的成本和临床阶段的风险,确认候选分子能成为药品的可能性,我们需要对其进行成药性评价。
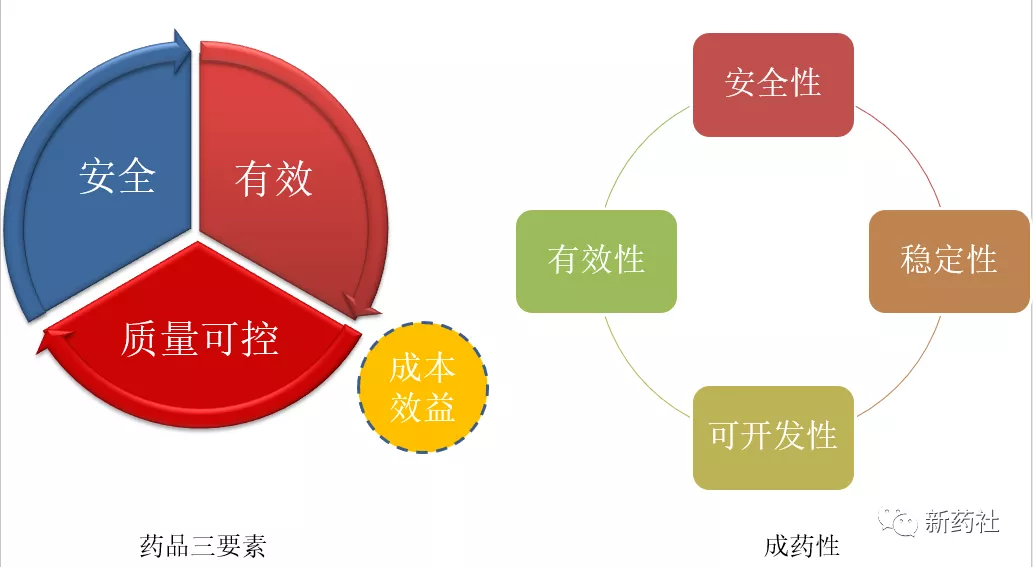
个人将成药性分为四个层面:安全的,有效的,稳定的,容易开发放大(适合进行工业化生产)的。那么怎么样高效、准确的评估,不同技术背景的公司给出的具体答案不尽相同,Merck团队总结概括了12个层面:
1.测定目标种属蛋白和潜在毒理学物种(例如非人灵长类动物(NHP)物种)的亲和力
需要确认抗体与人属目标蛋白(包括不限于靶点抗原、FcRn、FcγR等)特异性亲和力,同时该抗体最好可与食蟹猴属抗原、小鼠或大鼠种属有特异性结合,前者为非临床毒理、药代动力学等评估的模式动物,后者常作为概念验证模式动物以评估药效。若无结合,则需利用基因工程技术,使这些模式动物表达人属抗原后方可进行测试。
2.利用工程细胞系进行各种体外功能测定的功能活性/效价初级试验
建立各类细胞功能学方法,以评估抗原抗体结合后引起的下游信号通路的改变,从而确认抗体的活性。
3.结合特异性(无非特异性结合、无与目标序列或结构同源的同源蛋白的结合)
应利用Elisa、SPR、BLI、ITC等方式,测定抗体与目标蛋白、与目标序列或结构同源的同源蛋白的结合、以及无关蛋白的亲和力,以确认结合的特异性,减少脱靶导致的快速清除和毒副作用。
4.序列和表位多样性(预测及实验评估)
应通过软件分析及实验确认氨基酸序列确认潜在风险,包括亚型、分子量、半胱氨酸配对等,通过软件预测及实验确认抗体与抗原结合的表位结构,了解抗体发挥作用的机理及与其他相似抗体的异同。
5.胶体性质评估(聚集、蛋白-蛋白相互作用)
利用AC-SINS、CSI-BLI、kD\G22\B22、粘度等筛选方法和评价指标,以评估抗体本身存在的自相互作用情况,以期得到存在相互斥力的分子,以避免蛋白间相互吸引导致聚集体、颗粒物的产生。
6.疏水性和溶解度评价
较强的疏水性可能与聚集增加或非特异性结合的风险有关,同时亲水性较低会引起溶解度过低,导致工艺过程的尤其是浓缩过程中的沉淀,也无法制备成高浓度制剂。
7.热稳定性和构象稳定性
通过DSF、DSC、SLS、DLS等技术评估蛋白热解折叠,聚集、颗粒变化等,以评估抗体热稳定性,具有良好的热稳定性的分子更利于长期存储中保持稳定。
8.通过评估CDR区域(如脱酰胺化、异构化、氧化、N -糖基化位点)的序列可靠性(溶剂暴露时残基的修饰)来评估化学稳定性
通过序列分析以及强制降解试验,发现潜在的翻译后修饰,通过评估此修饰对于结合和功能的影响确认是否为关键质量属性,进而确认是否需要进行序列优化或后续控制策略。
9.蛋白水解、断裂的敏感性,以及在平台配方缓冲液的稳定性(压力条件,如提高温度、冷冻存储、冻融循环、pH突跃)
利用强降解条件,评估蛋白水解、断裂的敏感性,以发现正配率低、易于降解的分子。
10.pI评价(理论计算和实验)
7-9 范围之外的pI可能导致纯化过程中的损失,以及病毒灭活的挑战。同时应避免CDR区域出现过大的带电区域。
11.瞬时CHO表达的表达量
一般而言,瞬转表达量与稳转表达量会有一定的相关性,高表达量会降低生产成本。此外,同等条件下,瞬转更高表达量一般预示着更高的热稳定性,也提供有关整体分子序列特异性和生物物理特性的有用信息,例如整体胶体特性,以及对不良PTM 的敏感性(例如,剪切)
12.纯化情况(纯化、过滤、浓缩过程中物质损失、目视观察到的浊度变化、缓冲交换或透析时絮凝)
通过理化性质预测,也应关注实际纯化过程的各抗体分子的实际表现,诸如柱上结合情况、低pH稳定性,稀释及浓缩时理化变化等。
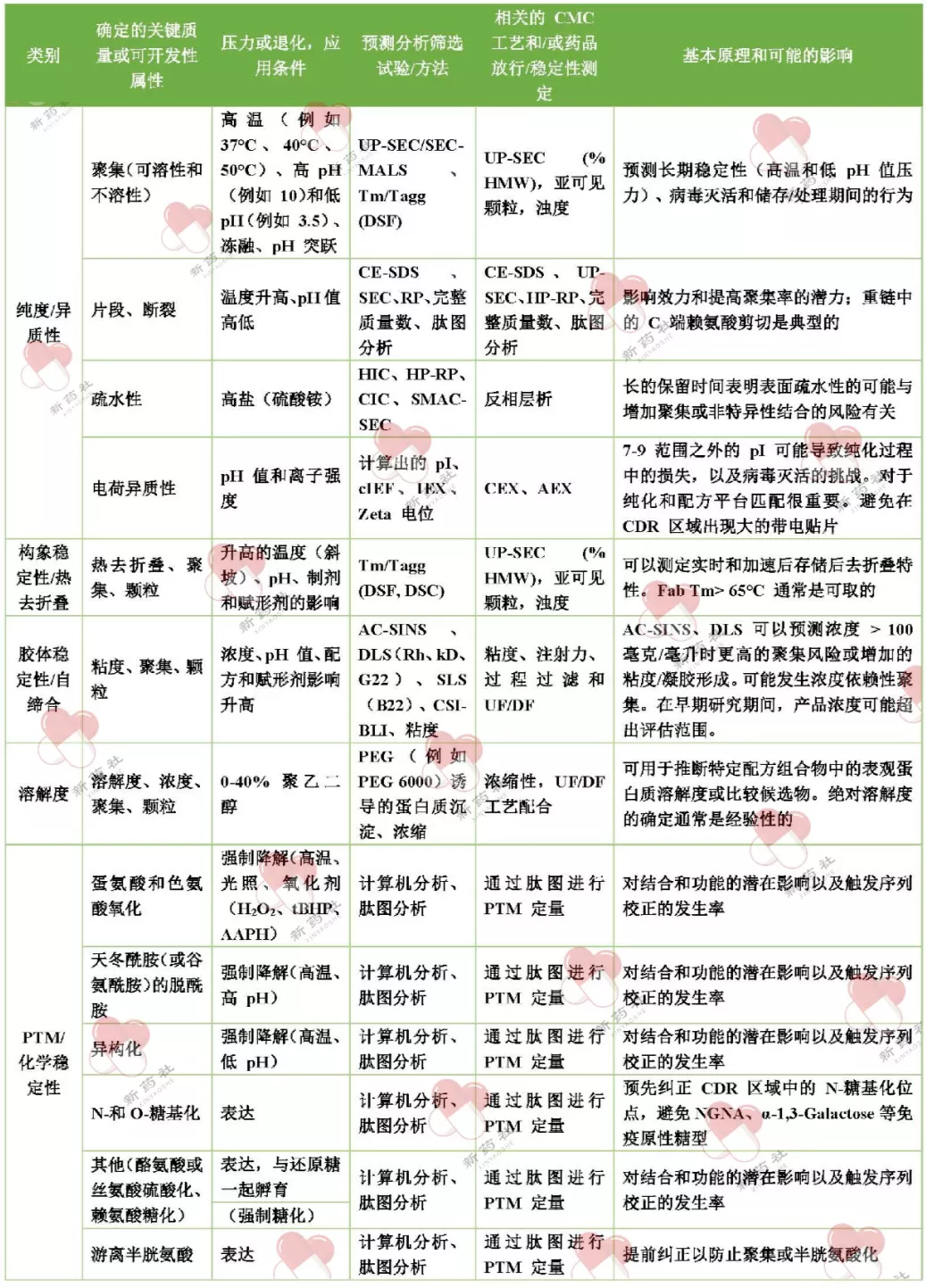
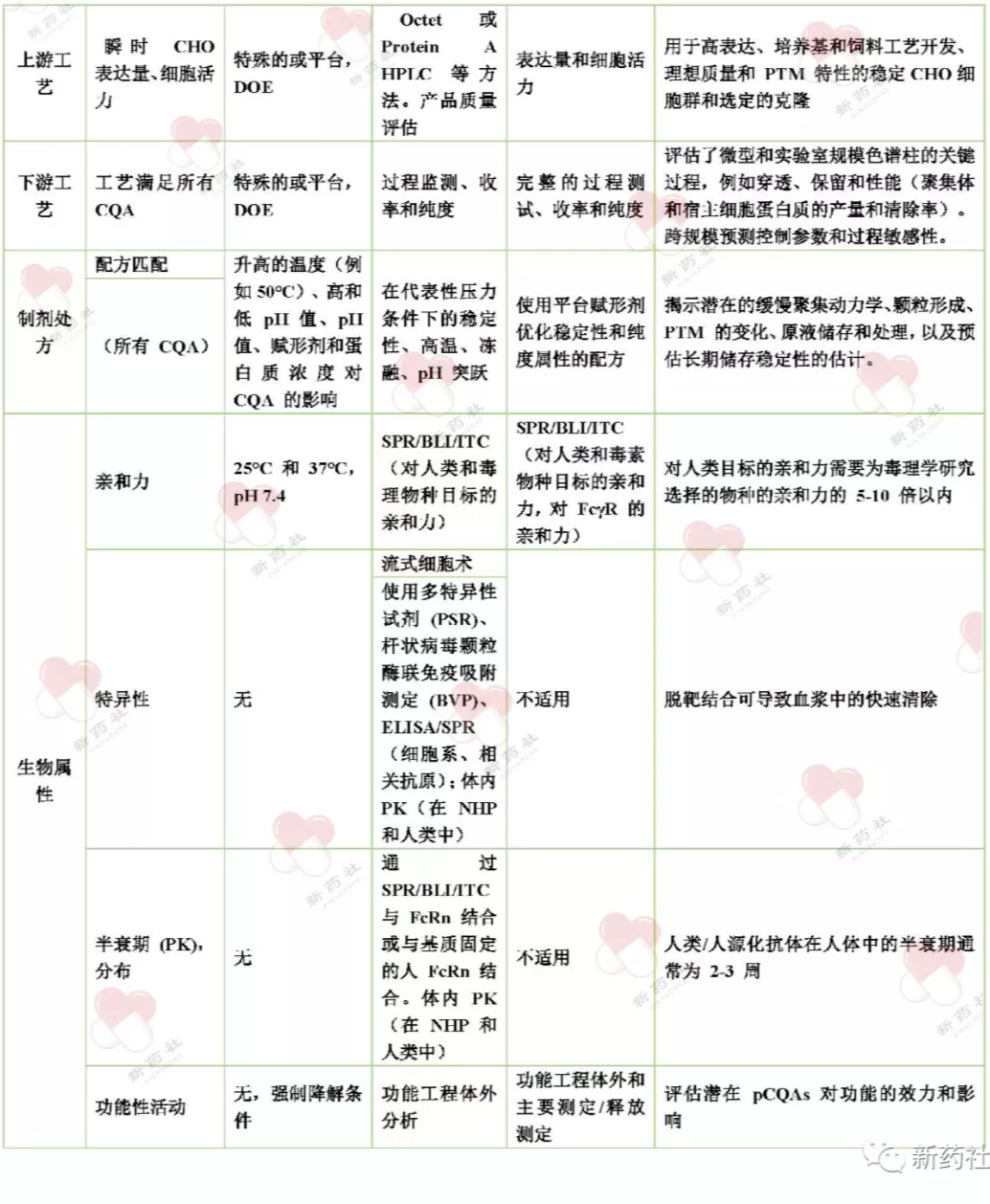
近年来,ADC、融合蛋白、双抗、多抗等新型结构不断开发,新型的评估手段不断产生,但总体原则并没有改变,成药性评估已被确认为最为重要的步骤之一,借助各类高通量分析手段,全面评估蛋白,每个企业均可结合实验室实际搭建自身的成药性评估平台,从候选分子中筛选出最佳分子,为后续工艺开发乃至后期药品上市打下牢固的基石。
参考资料
- https://mp.weixin.qq.com/s/M1DVWzS1uXuDidlUSbzGdQ
- Bailly M, Mieczkowski C, Juan V, et al. Predicting AntibodyDevelopability Profiles Through Early Stage Discovery Screening. MAbs.2020;12(1):1743053. https://www.tandfonline.com/doi/full/10.1080/19420862.2020.1743053
