【4.7.1】IgG分子的二硫键结构
几十年前,从在免疫球蛋白表征重组和人单克隆IgG抗体发现二硫键结构,二硫键就一直受到关注。首先在IgG4中鉴定非经典的二硫键结构,然后在IgG2抗体中鉴定。尽管半胱氨酸残基应处于二硫键键合状态,但已在IgG抗体的所有亚类中检测到游离巯基。此外,二硫键易受化学修饰的影响,其可进一步产生结构变体,例如具有三硫键(trisulfide)或硫醚键(thioether)的IgG抗体。还观察到所有亚类的IgG形成三硫键。通过β-消除降解二硫键产生游离巯基二硫化物和脱氢丙氨酸。游离巯基和脱氢丙氨酸之间的进一步反应导致形成不可还原的交联物质。脱氢丙氨酸残基的水解基本上有助于抗体铰链区(hinge region)片段化。本综述讨论了这些二硫键变化对抗体结构,稳定性和生物学功能的影响。
一、介绍
重组单克隆IgG抗体在蛋白质治疗剂中越来越被广泛应用。 IgG的二硫键结构通过进化高度保守,曾被认为是均匀(uniform)和均一(homogeneous)的结构特征。 然而,大量IgG分子的详细表征揭示了重组和天然人IgG抗体中的几种新结构特征。 这些新发现及其对IgG结构,稳定性和生物学功能的影响在这里进行了综述
二、 经典的二硫键结构 Classical Disulfide Bond Structures
四个IgG亚类的二硫键结构建立于20世纪60年代。这些二硫键结构被称为经典的二硫键结构,因为它们被广泛接受。如图1所示,关于IgG抗体IgG1,IgG2,IgG3和IgG4的四个亚类中的二硫键结构存在许多相似性和一些差异。每个IgG含有总共12个链内二硫键;每个二硫键与个体IgG结构域相关。两条重链通过可变数目的二硫键在铰链区( hinge region )连接:IgG1和IgG4为2,IgG2为4,IgG3为11。 IgG1的轻链通过轻链的最后半胱氨酸残基和重链的第五个半胱氨酸残基之间的二硫键与重链连接。然而,对于IgG2,IgG3和IgG4,轻链通过轻链的最后半胱氨酸残基和重链的第三半胱氨酸残基之间的二硫键与重链连接。
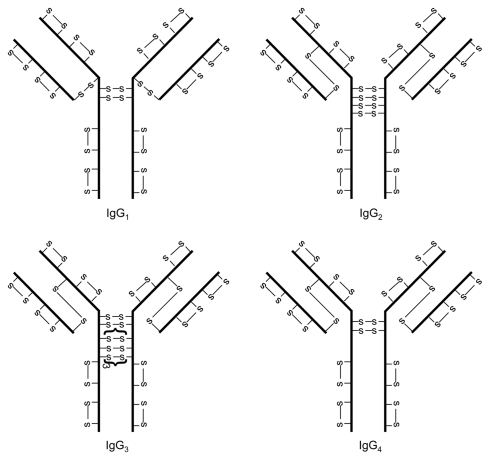
链内和链间二硫键之间的溶剂暴露水平不同。 形成链间二硫键的半胱氨酸残基位于铰链区,除了IgG2,IgG3和IgG4中重链的第三个半胱氨酸残基,其位于VH和CH1结构域的界面之间.因此,inter链二硫键是高度溶剂暴露的。另一方面,链内二硫键埋在每个区域内的两层反平行β-折叠结构之间,并且没有溶剂暴露。溶剂 暴露差异具有重要意义,因为暴露的半胱氨酸残基被认为比未暴露的半胱氨酸残基更具反应性。
三、 非经典类 Non-Classical Linkage
已经观察到除了图1中所示的经典结构之外的二硫键结构,主要针对IgG2和IgG4,但针对IgG1和IgG3没有观察到。 仅观察到少量的二硫键变体在IgG1的链内形式的两个重链间二硫键。 IgG3在铰链区具有重复的氨基酸序列,并且总共有11个二硫键紧邻 ,这对于形成二硫键变体不具有很大的灵活性。
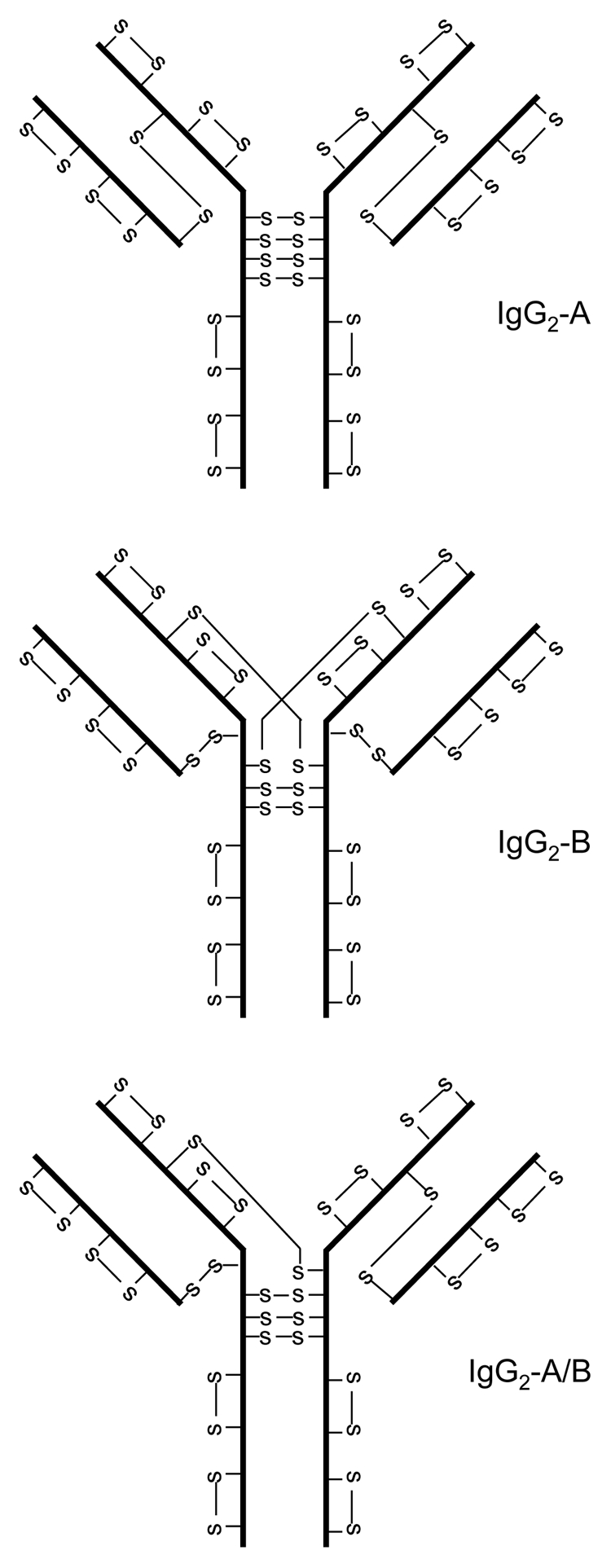
IgG2的非经典二硫键结构首先在重组单克隆抗体(mAb)中鉴定,然后在人IgG2分子中得到证实。在这些出版物中,经典的二硫键结构被称为IgG2A,而两个主要的非结构经典结构称为IgG2B和IgG2-A / B,后者被认为是IgG2A和IgG2B之间的结构中间体(图2)。不同二硫键异构体的分布取决于轻链的类型,IgG2A是具有λ轻链的分子中的主要形式; IgG2B是κ轻链分子中的主要形式。在细胞培养,体外培养与血清和患者血清中观察到从IgG2A形式到IgG2B的转化。分子动力学模拟研究表明,硫原子在链二硫键具有高度流动性并且可以非常接近。因此,观察多种二硫键同种型共存IgG2抗体并不令人惊讶。除了来自不同分子内二硫键连接的同种型外,在来自细胞培养物和人血清的重组IgG2中也发现了二硫键连接的IgG2二聚体。
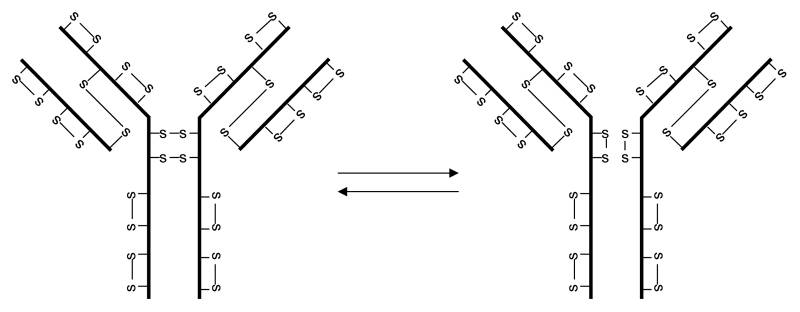
到目前为止,IgG4是最知名的具有非经典二硫键结构的IgG分子亚类(图3)。几个有趣的观察结果导致了非经典二硫键结构的最终发现。首先,当通过非还原十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析时,观察到最明显的IgG4为半分子,而不是通过在天然条件下运行尺寸排阻色谱(size-exclusion chromatography,SEC)看到的,表明两个半分子通过非共价相互作用而不是通过共价键相关联。其次,多克隆IgG4不能交联抗原并且表现得像单价抗体,而单克隆IgG4可以交联抗原。第三,作为共价连接单体的IgG4表现出血浆中的双特异性。这些观察结果表明,IgG4的两个重链间二硫键与链内二硫键形成平衡。IgG1和IgG4在中间铰链区相差一个氨基酸,即IgG1中有两个脯氨酸残基和IgG4中的丝氨酸和脯氨酸残基。通过用脯氨酸残基取代丝氨酸残基获得稳定的IgG4重链间二硫键。由于重链间二硫键的不稳定性,可将对两种不同抗原特异的等量的两种重组IgG4抗体注射到免疫缺陷小鼠体内,可在还原剂存在下体外形成双特异性抗体。
IgG4二硫键同种型:
四、游离巯基 Free Sulfhydryls
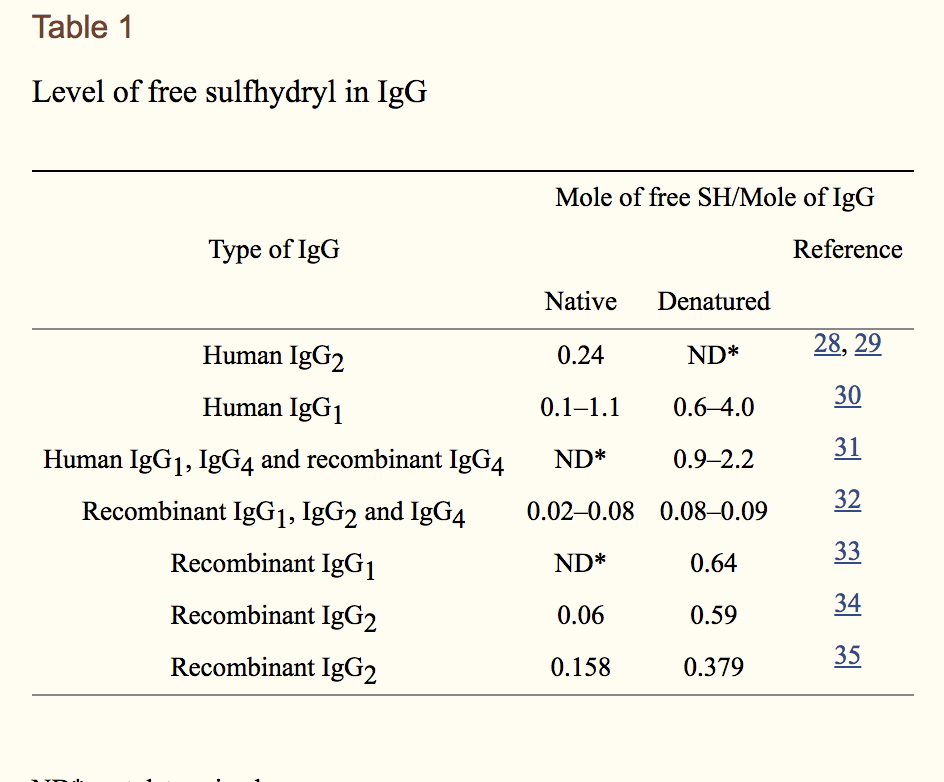
据推测,IgG中的所有半胱氨酸残基都处于二硫键连接状态。然而,在IgG分子中常规检测到游离巯基,包括来自血清和重组mAb的IgG(表1)。值得讨论表1中的两个重要观察结果。首先,在变性(denaturing)下检测到更高水平的游离巯基与天然(native)条件相比的条件。这表明游离巯基与链内和链内二硫键中涉及的半胱氨酸残基相关。其次,在不同的研究中,在变性条件下游离巯基的水平存在很大差异。这种大的变异可能是由于多种因素的组合,包括不同的IgG类型(人或重组),不同的IgG亚类和实验变异,例如变性试剂和变性时间,其可以针对不同的IgG变化以完全变性。二硫键可能降解发生产生游离巯基,这将在后面讨论。
虽然IgG分子可能具有不同水平的游离巯基,但研究表明在结构域中游离巯基的分布相似,至少在重组IgG1是这样。轻链中可变结构域具有比在恒定结构域中更高水平的游离巯基。 CH3结构域具有最高水平的游离巯基,其次是CH1,CH2和重链中的可变结构域。最低水平的游离巯基与链间二硫键相关,表明低水平的游离巯基最可能是由于二硫键的不完全形成。因为具有较高溶剂暴露水。其他的分布是特殊的二硫键没有有效生成的特例。
到目前为止,文献报道了两个特殊例子。 在这两种情况下,重链可变结构域中的链内二硫键未完全形成,其水平使得通过疏水相互作用或弱阳离子交换色谱检测到具有这种不完全二硫键的抗体。通过向细胞培养物中添加硫酸铜可以完全形成特殊二硫键,这表明细胞培养条件可以影响二硫键的形成。 在血清中体外孵育或从大鼠血清中回收的抗体,不完全的二硫键形成显着的减少。
五、B-消除 β-Elimination
在一般条件下,二硫键可以通过β-消除机制分解,形成脱氢丙氨酸(dehydroalanine)和过硫化物(persulfide),可以进一步恢复到半胱氨酸残基。IgG的轻链和重链通过β-消除机制,二硫键的降解 ,随后交联所得的半胱氨酸和脱氢丙氨酸,导致形成不可还原的硫醚键,在4℃和高达13.6储存的重组单克隆IgG1,发现在热应力样品中比例为〜0.4%。。 随后的脱氢丙氨酸水解是除肽键水解之外的另一重要机制,其导致铰链区中的抗体片段化
六 、 三硫键形成 Trisulfide Bond Formation
三硫键(Trisulfide bonding)形成是蛋白质的罕见翻译后修饰。首先报道了重组单克隆IgG2存在三硫键,其中四个重链间二硫键中的一个或两个可能以三硫键形式存在。后来在重组IgG抗体的所有亚类中检测到三硫键,以及在所有病例中,在通常形成轻链的半胱氨酸残基和重链二硫键之间观察到更高水平的三硫键。重组mAb中的三硫键被认为是在发酵过程中形成的,由完整的二硫键与溶解的硫化氢(H2S)的反应。这一结论得到了以下观察结果的支持:IgG与H2S的孵育导致了更高水平的三硫键结合。当重组IgG2抗体在pH 7.5和的各种还原试剂一起温育时,三硫键大量转化为二硫键。在另一项研究中,表明三硫键在pH 6.5的缓冲液和体外大鼠血清中是稳定的。然而,当在腹膜内注射从大鼠血清中回收重组IgG1的24小时后,实现了三硫键完全转化为二硫键。猜测,在适当的氧化还原条件下, HS对二硫键的初始亲核攻击,产生的几种反应中间体形成三硫键。
七、结构,稳定性和功能 Structure, Stability and Functions
非经典结构和三硫键的结构、稳定性和功能影响的信息是有限的。 通过SEC和分析超速离心测定,IgG2B的非经典结构比IgG2A的结构更紧凑。 IgG2A显示出与IgG2B具有相似或更高的结合亲和力和生物活性。研究确定存在 三硫键似乎不影响热稳定性或抗原结合。有关IgG4同种型(isoforms)的有限信息主要来自诱变研究。 两个突变体,一个用丝氨酸替换第一个中间铰链半胱氨酸,另一个用脯氨酸替换中间铰链中的丝氨酸,导致更稳定的IgG4分子而不影响抗原结合活性。在另一项研究中,替换中间铰链丝氨酸 与脯氨酸结合导致更稳定的链间二硫键和增加的半衰期,同样不影响抗原结合活性。
使用单个结构域以及完整的IgG分子研究了游离巯基对IgG的结构/稳定性和生物学功能的影响。没有完整的链内二硫键的CL结构域,CH3结构域和单链可变片段的各个结构域显示出较低的稳定性,但没有实质的结构变化。预计其他结构域中链内二硫键的缺乏将具有类似的去稳定作用,因为所有IgG结构域具有相似的折叠。重组单克隆抗体的重链可变结构域中二硫键的不完全形成导致效力的显着降低。源自ABPC48小鼠浆细胞瘤的天然抗体,其中重链可变结构域中的第二个半胱氨酸残基被酪氨酸残基取代,能够结合抗原,进一步表明完全二硫键不是抗原结合的先决条件。较高量的游离巯基导致重组和人IgG抗体的较低热稳定性。此外,与IgG1相比,IgG2的聚集倾向更高,归因于IgG2的游离巯基水平更高
部分还原是研究链间二硫键对IgG结构,稳定性和生物学功能影响的常用方法之一。尽管未观察到全局构象变化,但部分还原增加了铰链区的柔性,可能是由于链间二硫键的减少,导致两个CH2结构域的进一步分离。在部分还原和烷基化时也观察到人IgG1,IgG2和IgG4的流体动力学大小明显增加,但IgG3的大小减小,这再次归因于铰链区和CH2结构域的结构变化。高度依赖于实验条件,部分减少要么没有影响,要么降低补体激活效率。部分还原对Fc受体结合以及因此抗体依赖性细胞介导的细胞毒性(ADCC)的影响也不一致,例如,对于不同抗体没有观察到效果和活性显着的降低。其中一个关键问题是不同研究中链内二硫键的还原程度。据报道,只有人IgG1的链间二硫键易于在天然条件下还原。然而,天然条件下兔IgG的链内二硫键可能减少。
尽管游离巯基的含量似乎很低,但它们的存在对重组单克隆抗体制剂提出了一些挑战。发现大部分IgG1二聚体是由于形成分子间二硫键而形成的,这可能是由游离巯基形成的。在热应激后pH6.0时,通过二硫键形成的二聚化是重组单克隆IgG2抗体的主要聚集途径。通过搅拌引起的聚集体中,也发现了大量通过IgG2的二硫键形成的共价连接的聚集体。具有不完全二硫键的抗体可能在各种胁迫条件下更容易解折叠,因此通过二硫键形成具有更高的共价聚集倾向。具有较高游离巯基水平的IgG抗体也具有更大的暴露疏水区域的倾向,这可通过分子间疏水相互作用驱动非共价聚集体的形成。
八、总结
由于翻译后修饰,异质性(Heterogeneity)是重组mAb的共同特征,并且与二硫键结构特异性相关的变异(variation)是异质性的潜在主要贡献者。 已经清楚地证明,在抗体装配后,链内二硫键通常更稳定。 因此,与这些链内二硫键相关的低水平游离巯基,可能是由于二硫键的不完全形成。 另一方面,链间二硫键暴露并且不太稳定,这解释了为什么增加的异质性与这些键相关联。 因此,假设在抗体装配后可能发生非经典的二硫键结构,三硫键和硫醚键形成是合理的。
由于观察到结构和稳定性的变化,因此在重组mAb的开发过程中应该密切关注这些新的二硫键相关结构。 从理论上讲,向人类施用非天然二硫键结构有可能引发免疫反应。 降低稳定性还可以最终导致非天然结构,因为更高的展开倾向和形成聚集体。 因此,需要更多实验来提高对二硫键相关结构变体对IgG分子的稳定性,结构和生物学功能的影响的理解。
参考资料
- MAbs. 2012 Jan-Feb; 4(1): 17–23. Disulfide bond structures of IgG molecules ( https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3338938/ )
