【4.4.8】疫苗设计中表位的预测--iVAX工具包
计算疫苗学(Computational vaccinology)包括使用计算工具,抗原决定簇定位,抗原选择和免疫原设计(epitope mapping, antigen selection, and immunogen design)。计算机模拟预测对生物威胁,新发传染病和癌症的免疫反应的工具,可以加快新型和下一代疫苗的设计并将其交付临床。在过去的20年中,总部位于美国罗德岛普罗维登斯的疫苗学家,生物信息学专家和高级程序员已经推动了疫苗设计集成工具箱iVAX的开发,该工具箱可通过互联网安全且用户可访问。这套完整的免疫信息学工具集包括用于对候选抗原进行评分和分类,选择具有免疫原性和保守性的T细胞表位,重新设计或消除调节性T细胞表位以及重新设计抗原以诱导免疫原性和预防人类和牲畜疾病的算法。 iVAX的商业和学术应用包括在基于T细胞的人多表位Q发热疫苗(multi-epitope Q fever vaccine)的开发中鉴定免疫原性T细胞表位,设计新型流感疫苗,为疟疾疫苗鉴定交叉保守的T细胞表位以及分析免疫临床疫苗研究中的反应。迄今为止,动物疫苗的应用包括猪的病毒感染,例如甲型猪流感,PCV2和非洲猪瘟。生物防御的“快速射击”应用包括拉萨热和Q发烧(Lassa Fever and Q fever)的示范项目。由于最近的传染病暴发强调了疫苗驱动的准备工作的重要性,因此iVAX工具包上可用的集成工具集随时可以帮助疫苗开发人员提供基因组衍生的,由表位驱动的疫苗。
一、前言
在过去的20年中,学术研究人员和商业公司开发了免疫信息学工具来发现激活免疫系统的T细胞表位“触发器”(triggers),并将这些工具应用于疫苗设计。由于对免疫学检查点抑制剂引入肿瘤学领域产生了基于表位的疫苗的新兴趣,以及对新病原体如nCOV- 2019(SARS-CoV-2)的出现,最近发现表位和设计疫苗的算法开发步伐加快了。
这篇综述将描述作者开发的疫苗设计工具及其在广泛合作中的表位发现,抗原工程和免疫学研究中的应用,如若干案例研究所示。从T细胞表位的发现开始,我们说明T细胞表位如何与疫苗安全性,功效,抗原表征,抗原工程和疫苗设计相关。我们认为,T细胞表位在疫苗开发中应引起更大的关注,因为即使没有有效的抗体反应,T细胞表位也是抵抗病原体的免疫防御的重要驱动力,也可能促进它们逃避免疫防御。具体而言,有关病原体T细胞表位与人类基因组(和微生物组)之间的交叉保守性的新信息正在出现,并且对疫苗设计具有重要意义。例如,交叉记忆的T细胞表位的“记忆”(memory” of cross-conserved T cell epitopes)已被定义为疫苗产生的保护强度的关键因素(2-4)。这些发现通过使用免疫信息学检查T细胞表位及其在疫苗中的作用的新工具的应用而得以揭示。
这里描述的最新工具之一解决了免疫伪装(immune camouflage)的概念(图1)。 从2013年开始,我们观察到某些病原体呈递的TCR表位包含的氨基酸模式与绑定到相同HLA等位基因的T细胞表位相同,并在人类蛋白质组中高度流行(5、6)。 我们假设这些“类人” T细胞表位的作用,可能是通过激活抑制免疫应答的自反应性Tregs来耐受病原体(7)。 我们还观察到,在具有修饰抗原能力的病原体中,免疫伪装的可能性更高(8、9)。 我们已经获得证据,表明这一概念也与癌症疫苗有关,并且可以提高此类疫苗的安全性和有效性(10)。

在回顾性研究(5)和前瞻性研究(4-10)中验证了免疫伪装假设之后,我们在iVAX中新开发了一种名为JanusMatrix的工具,该工具可将其他人样抗原决定簇分类。我们强调了人类样T细胞表位在废除有效疫苗反应中的重要作用。此外,我们使用了名为OptiMatrix的工具来设计免疫工程疫苗,该疫苗可通过去除人样表位来增强免疫原性(11)。在本文所述的其他iVAX工具包方面,我们探索了对新抗原的HLA限制或“个人”免疫反应的性质,并开发了专门的工具来应对这些类型的评估,称为iTEM(个体化T细胞表位测定)和EpiCC (表位内容比较)。在接下来的部分中,我们将介绍最新的iVAX工具,说明该工具在当前疫苗开发计划中的应用,并重点介绍与针对多种人类和动物病原体的疫苗开发相关的最新合作。
二、方法:新的免疫信息学工具和iVAX工具包
计算疫苗设计(也称为计算疫苗学)通过使用计算工具进行表位作图,抗原选择和免疫原设计。在计算机上预测对新兴传染病和癌症的免疫反应可以加速新型疫苗和下一代疫苗的设计。 iVAX工具包是自1998年以来一直在开发的一套完整的免疫信息学算法。它包括一套免疫信息学算法,用于对候选抗原进行分类,选择具有免疫原性和保守性的T细胞表位,消除潜在的调节性T细胞表位以及优化抗原的免疫原性。虽然该工具包的各个方面已经发布[请参阅(12-14)],但截至2015年,iVAX工具包已进行了重大升级,新工具已经集成,新工具的验证已经发布。在这里,我们将重点介绍最新的工具,并提供iVAX应用程序的图解示例。
2.1 iVAX工具包概述
如图2所示,iVAX包含大量工具,这些工具可以顺序或单独使用,来操纵从核心T细胞表位作图工具EpiMatrix(15)衍生的信息。之前已经非常详细地描述了诸如Conservatrix,EpiMatrix,ClustiMer和EpiAssembler算法之类的工具(14)。较新的工具包括VaxCAD算法(16),该算法可创建串珠状疫苗设计,同时将在将一个表位连接到另一个表位的过程中可能产生的有害的连接表位最小化。自2015年以来已整合到网站中的其他工具包括JanusMatrix,这是一种专门定制的同源性分析工具,可检查MHC:TCR接口上任何给定肽的病原体/宿主序列相似性,并预测潜在的交叉保守表位,从而使候选序列具有优先从疫苗构建体和iTEM中排除潜在的宿主交叉保守性(在TCR面上),它可以根据其HLA单倍型分析个体对疫苗抗原的免疫反应。后两个工具也已集成到单独的管道中,用于称为Ancer的个性化癌症疫苗设计,该管道已获得EpiVax Oncology的许可,这是EpiVax的投资方支持。

2.2 使用EpiMatrix评估蛋白抗原的免疫原性潜力
每个疫苗设计项目都始于对T细胞表位含量的分析。使用EpiMatrix(15)进行I类HLA配体或II类HLA配体(和推定的表位)的搜索。从数据库如GenBank或UniProt获得的抗原序列以FASTA格式输入。从理论上讲,没有必要限制输入序列的数量,实际上已经分析了整个宿主基因组(例如结核分枝杆菌,Mallkholderia mallei和拟假小肠以及Burnixii)(17,18)。
为了执行EpiMatrix表位映射分析,首先将每个输入序列解析为重叠的9-mer帧(I类为10-mer帧)。然后使用EpiMatrix(19)评估已解析的9-和10-mer的模式,该模式与已知的HLA结合偏好相匹配,该模式与一组9种常见的“超型” II类HLA等位基因或6种I类超型等位基因相匹配。选择这些等位基因是因为它们在人群中相对常见,并且彼此相对不同,并且每个超型均具有HLA结合偏好,其功能上等同于或几乎等同于许多其他家族成员等位基因。总体而言,九个HLA II类超型等位基因及其各自的家庭成员覆盖了人类群体中存在的大多数HLA类型的95%以上(20),而六个超型等位基因以及它们各自的家庭成员,覆盖超过98%的人口,包括东亚人口(21)。
尽管通常在人群水平上进行抗原分析,但在许多情况下可能仍需要进行更精确的逐HLA分析。在过去的5年中,EpiMatrix进行了更新,以包括比标准的六个I类“超型”和II类“原型”(现在有2,217个I类和612个II类等位基因)更多的HLA等位基因以及鼠类(H Balb / C和C57Bl / 6的-2K,H-2D,IA和IE单倍型)和猪SLA等位基因的表位预测(22)(现在有15个I类和8个II类等位基因)。这种评估一组HLA的能力使个性化预测成为可能,从而使该工具包可用于评估个体受试者对疫苗抗原的反应,或用于探索HLA特有的病原体逃逸漏洞。
先前已经描述了用于生成基于EpiMatrix矩阵的预测变量的数据(15)。工具开发的来源包括免疫表位数据库(IEDB),例如,其中已经收集了25,764个独特的T细胞表位,HLA配体和人类HLA A * 0101等位基因的洗脱肽。超过39个I类矩阵和42个II类矩阵均基于相似的大型数据集。从这个起点开始,我们将应用内部算法来清理数据库,以向下选择可通知矩阵的表位的最终列表。如最近对已发布的HLA I类配体进行的头对头比较所示,高质量的粘合剂的精心管理和低质量的粘合剂的去除使EpiMatrix的性能(平均水平)优于其他工具(图3)。
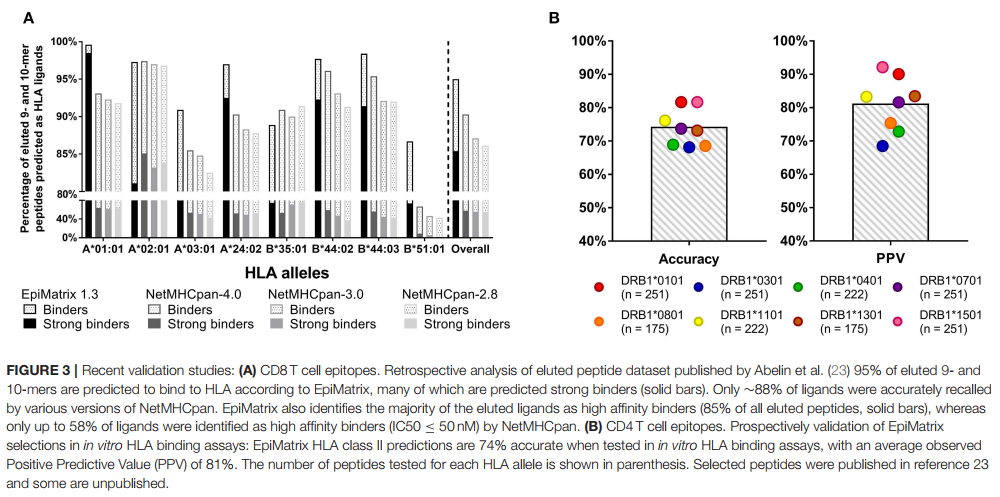
图3A显示了洗脱肽的EpiMatrix评分与其他公开工具(NetMHCpan)生成的肽的最新比较,这是由于大量洗脱肽的发布才有可能的(23)。 图3B显示了在EpiVax(公开和未公开)进行的有关HLA II类限制性表位的最新HLA结合研究。 在赠款资助的研究合作过程中,还发表了其他T细胞表位和HLA结合验证研究,描述了在体外使用人淋巴细胞对T表位对预测表位的免疫反应[见(4,24–32)],以及前瞻性研究, 鼠模型的体内免疫原性和疫苗功效研究[参见(10,18,33–38)]。
2.3 扩展抗原的潜在免疫原性 Scaling Antigens for Their Potential for Immunogenicity
T细胞表位含量
为了选择用于疫苗设计的抗原,重要的是要考虑免疫原性的总体潜力,这与细胞毒性T细胞(CTL)或T辅助(Th)T细胞表位的含量直接相关。即使佐剂和先天免疫系统的作用对于免疫原性至关重要,但如果没有T细胞表位使活化的免疫系统起反应,这些“危险信号”就不太可能有效。因此,我们假设抗原中所含的HLA配体和推定的T细胞表位的浓度越高,它诱导免疫反应的可能性就越大。
前瞻性研究普遍支持该假设,但需注意的是,校正Treg表位的总T细胞表位计数可能很重要,但是大规模进行该分析的方法尚未得到广泛验证在前瞻性研究中,交叉保守性的阈值尚未得到广泛测试(对于完整抗原),因此,我们的小组更喜欢逐案(case-by-case basis)评估抗原以评估推定的Treg表位。
蛋白质免疫原性量表
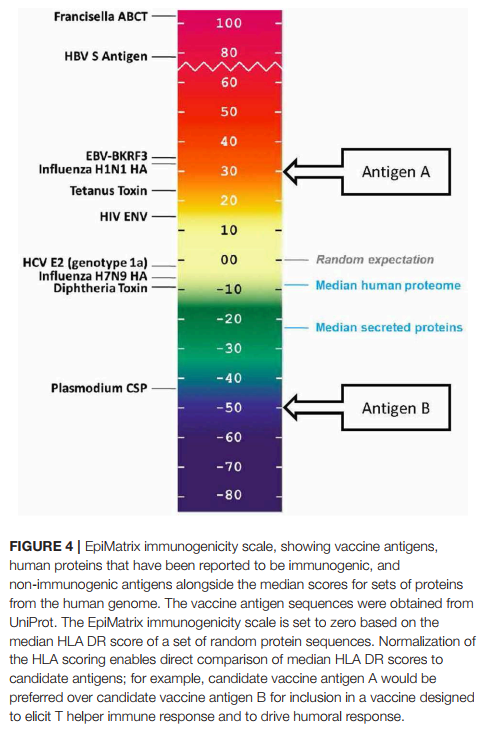
T细胞表位浓度可以表示为EpiMatrix Protein Score, 这是随机蛋白质序列中预期的预期T细胞表位数量与EpiMatrix系统在给定蛋白质中预测的假定表位数量之间的差异,并针对长度进行了标准化(每1000个氨基酸)。 将10,000个随机生成的蛋白质序列中包含的T细胞表位的平均数目设置为零,在此标准化规模上,高度免疫原性疫苗抗原得分高于20。
抗原与人类蛋白质的比较
在此规模上,人类蛋白质的得分通常低于随机生成的蛋白质。在最近对人类蛋白质的II类HLA DR T细胞表位含量进行的评估中(39),发现整个人类蛋白质组的中位数为-9.05,这表明T细胞表位可以支持有害的自身免疫活性,往往以低于预期的数量出现。分泌蛋白的中值得分更低,为-23.08,这表明具有更大可能性被APC吸收和呈递的蛋白会进一步解除免疫。
换句话说,就T细胞表位含量而言,将人类蛋白质组“解除免疫”可能在进化上是有利的(如图4中蓝色所示)。我们在2006年首次描述了这一概念,当时我们提出“自我免疫”自身蛋白质以减少自身反应的可能性可能是有利的(40)。对于某些但不是全部人类病原体,也观察到了类似的倾向(8、9)。
2.4 区域免疫原性
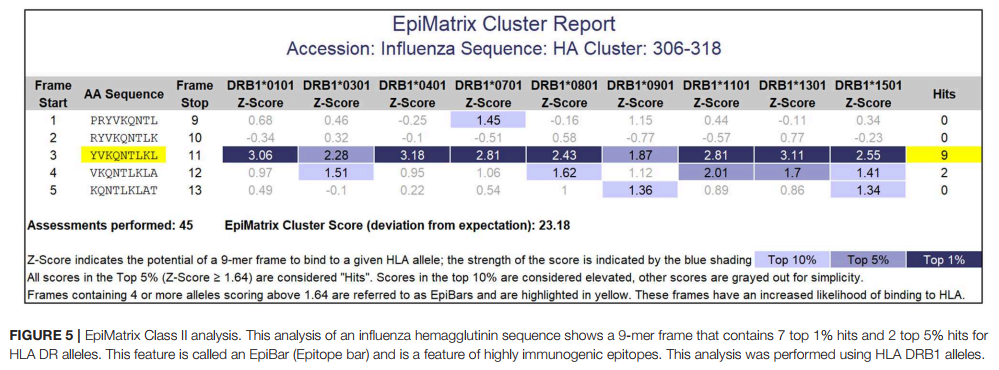
给定蛋白质的标准化EpiMatrix蛋白质评分可以很好地代表免疫原性,但是,区域免疫原性也可以确定蛋白质的免疫原性。已经观察到T细胞表位聚集在蛋白质序列的区域中。使用ClustiMer(iVAX中的簇发现算法)定义T细胞表位“簇”。簇的长度范围可以从9个氨基酸到大约25个氨基酸,并且可以包含4个到40个HLA结合基序。得分高于10的T细胞表位簇被认为具有显着的免疫原性潜力。一些T细胞表位簇包含单个9-mer框架,该框架可能包含可与至少四个不同的HLA等位基因结合的序列。 iVAX在EpiMatrix报告中以其条状外观将该功能表示为“ EpiBar”。
包含混杂结合的表位(例如EpiBars)的肽可能是非常强大的免疫原。实例包括用作T细胞测定对照的著名T细胞表位(41),包括流感血凝素306-318(图5),破伤风毒素825-850和GAD65 557-567。我们已经观察到暴露于Tularemia或Vaccinia的受试者中有100%对包含20至50个混杂表位的T细胞表位库有反应(25、26)。
簇也是自身蛋白的重要特征,经常参与自身反应性T细胞反应。众所周知的“自身表位”,例如胰岛素肽C23-A2(LQPLALEGSLQKRGI)包含大量的HLA DR结合基序(42)。为了更好地定义免疫原性表位,我们已经确定EpiMatrix簇得分的截止点为10(大致定义为与HLA结合的重要“命中数”除以序列长度),是高度免疫原性簇的特征。
此外,与人类基因组中大多数蛋白质普遍观察到的“去免疫”趋势相反,我们发现补体因子3亚基D(C3d)的T细胞表位浓度较高,这表明它可能发挥重要的作用。当它与抗原结合并被B细胞吸收时,提供非关联帮助驱动体液免疫反应的功能。该肽位于先前定义的C3d的P28“佐剂”区域,该区域在物种间完全保守(43,44)。 P28中单个T细胞表位的突变导致该肽在小鼠中的佐剂活性大大降低(45),这支持了该表位激活自身反应性T辅助细胞从而桥接先天性和适应性免疫的假说。
2.5 JanusMatrix和类似于人的T细胞表位
尽管以前认为具有抗自我TCR的T细胞可能会在胸腺中消除,但有证据显示抗自我免疫反应也受识别相同抗原的调节性T细胞控制(46、47)。这些调节性T细胞的表型可以通过重复暴露于其同源自身抗原来加强(48)。因此,人对新抗原的免疫反应受胸腺的先前经验和免疫系统成熟过程中暴露驱动的增强作用的影响。
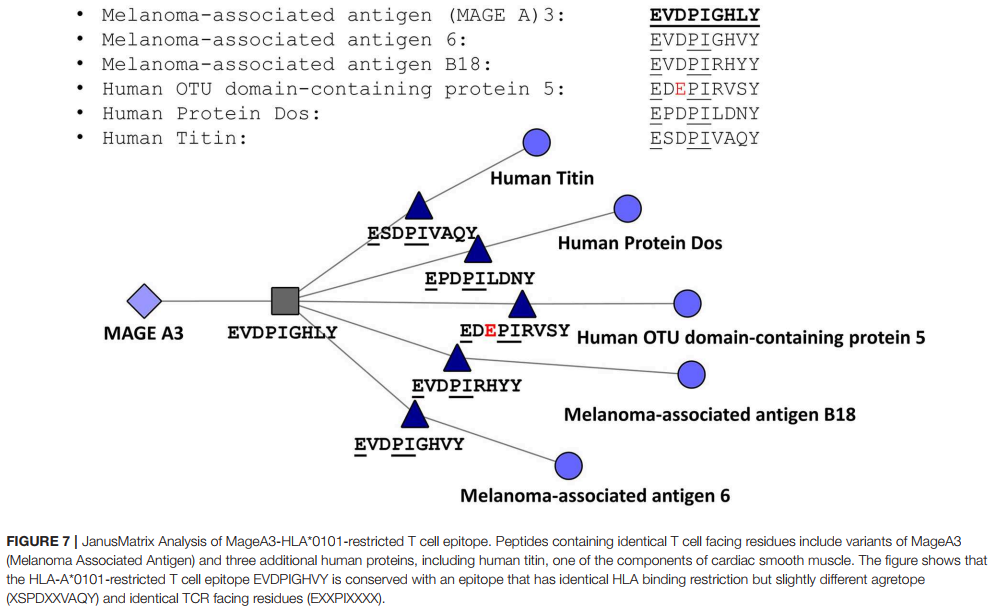
2013年,我们观察到来自人类病原体的关键抗原包含与自身抗原高度保守的T细胞表位,并假定这些表位在接种疫苗后可能诱导对该抗原的“无知”或主动耐受,从而导致“免疫伪装”( 7)。在回顾性研究中,我们确定在人类蛋白质组中具有同源但与MHC结合锚具有相容性但不完全匹配的肽表位和面对TCR的轮廓完全匹配的肽表位有可能被忽略(缺乏免疫反应)或诱导活性耐受性(激活在旁观者分析中具有免疫抑制作用的T细胞和/或表现出与已知具有调节性T细胞表型的T细胞一致的细胞表面标记)。我们开发了JanusMatrix工具来识别这些类似人的抗原决定簇,并一直在探索修饰和排除这些抗原决定簇对提高疫苗抗原性的影响(49)。
对于任何给定的T细胞表位,JanusMatrix定义了与MHC分子接触并结合的氨基酸,还确定了与响应T细胞的TCR接触的那些氨基酸。对于II类受限表位,假定位置1、4、6和9与MHC接触,并且位置2、3、5、7和8可用于TCR(图6)。面对ICR的I类表位残基在等位基因之间有所不同。

然后,JanusMatrix算法在参考数据库(可以是人类,鼠类或其他生物)中搜索相似的表位,同时考虑了面对MHC的表位和面对TCR的表位的表位保守性。返回具有相容但可能不相同的序列的参比序列(即由EpiMatrix预测与输入肽结合相同的HLA的参比序列)并且与输入肽的TCR接触完全匹配的参考序列。对于给定的EpiMatrix得分,较高的JanusMatrix同源性得分表明T细胞认识到该表位可能对免疫耐受表现出偏见,这一假设已在回顾性和前瞻性研究中得到证实(14)。对于非自身蛋白,我们使用两个截取值(在序列的长度上平均交叉保留的HLA等位基因特异表位),对于“自身”蛋白则使用三个截取值,以识别更可能与被宽容或积极监管。该临界值已发布(4)。
在该工具的首次前瞻性测试中,我们能够从JanusMatrix得分较高的丙型肝炎病毒(50个)中识别出T细胞表位,这些得分可在体外诱导调节性T细胞并抑制对其他肽的免疫反应。具体而言,JanusMatrix在非结构性HCV蛋白p7中鉴定了混杂的II类抗原决定簇,该抗原决定簇在TCR面部与数百种人类蛋白质组T细胞抗原决定簇具有同源性,并诱导PBMC培养物中CD4 + CD25 + FoxP3 + Treg数量和功能的增加,源自HCV感染患者的HLA多样化队列。
此外,我们在新兴的H7N9流感中发现了类似人类的抗原决定簇(6、11)。根据JanusMatrix的定义,II类限制性H7N9表位激活或调节效应T细胞反应的能力与其在人蛋白质组中具有相似表位的TCR面上交叉保存的程度有关。这些表位激活人CD4 + CD25highCD39 + FoxP3 + Treg,并抑制H7N9特异性效应T细胞反应(6)。 H7N9 HA中Treg诱导表位的删除产生了一种抗原性改良的HA,与野生型H7-HA相比,其刺激的活化效应CD4 + T细胞的体外刺激性增加了6倍,而抗H7-HA的刺激性则提高了5倍在人源化小鼠免疫中,IgG效价和抗H7-HA B细胞频率是野生型蛋白免疫小鼠的20倍(11)。
在生物领域,我们发现了免疫球蛋白G中保守的Treg诱导抗原决定簇(Tregitopes),并在几种自身蛋白中发现了TCR-face模式。我们继续证明Tregitope肽与多个MHC II类分子结合,抑制效应T细胞对共同递送的抗原的反应,上调Treg相关的细胞因子和趋化因子,并在体外诱导抗原特异性CD4 + CD25 + FoxP3 + Treg。体内(51,52)。虽然曾经被认为是新颖的,但天然调节性T细胞可以被人蛋白质中常见的具有面对TCR的基序的肽表位参与并激活的想法现在越来越受到关注(53),与JanusMatrix类似的概念也被其他人描述。研究小组(54,55)。
三、Results: Recent Case Studies using iVAX
四、结论
使用计算工具进行疫苗设计,使用完全体外系统测量疫苗效力以及使用广泛的灵活平台进行疫苗交付方面的进展,将疫苗科学从过去的传统“摇摇即烤”(shake and bake)(全杀灭疫苗)转移到了“预测和讲述”未来的设计方法。在过去的20年中,EpiVax及其附属学术机构的团队开发了设计疫苗的工具,并提供了体内和体外的证据,表明免疫信息学工具可以应用于可以有效防御活细菌和病毒攻击的疫苗。这些工具也可用于改善现有疫苗的设计并确定安全性和有效性的生物标记。在整个疫苗开发流程中有效整合计算机病毒免疫信息学工具以及离体/体外和体内免疫系统技术,将使开发人员能够预测和评估疫苗的安全性,毒性,功效,质量和性能,从而加速疫苗的开发。对广泛的病原体和物种进行安全有效的免疫治疗。
本报告中描述的新工具已经在此处简要介绍的回顾性研究和前瞻性研究中得到了验证(预期将在其他地方广泛发表结果)以及以前的出版物中。我们已经证明EpiMatrix和JanusMatrix算法可以有效地识别推定的T细胞表位,从潜在的调节肽中区分出可能的炎性肽,并且适合患者HLA特定水平的评估。这些结果证实,结合HLA特异性抗原决定簇含量和“自我”可提高对任一指标的免疫原性预测。在疫苗设计,抗原选择和工程设计的早期阶段同时使用这两种工具可能会导致下一代疫苗的发展,在这种情况下,可以提供最小的基本保护成分而不会产生脱靶或无意抑制疫苗的功效的信号。
许多商业和学术团队正在积极开发新的疫苗设计工具,还为计算疫苗学领域的创新做出了贡献。例如,几个小组开发了用于预测蛋白酶体切割位点:NetChop(70,I类:netMHC(71),netMHCpan(72),MHCflurry(73),EDGE(74)]和II类:netMHCII和netMHCIIpan(75),TEPITOPE(76),RECON(77)受MHC限制的T细胞表位,以及鉴定线性和不连续B细胞表位的工具BepiPred(78),DiscoTope(79)。
EpiVax,Inc.目前为客户提供“ iVAX工具包”,这些客户包括商业公司和学术合作者,他们正在开发用于疟疾,Q热和伯克霍尔德氏菌的新型疫苗,用于商业开发和生物防御合同;以及参与联邦政府资助的学术团体程序,用于分析对新兴/重新出现的病原体(例如流感(佐治亚大学,圣路易斯大学)和百日咳(Intravacc,Innatoss,VIC和CDC)的免疫应答)。甚至在最近,EpiVax还利用iVAX及其疫苗开发和称为Ancer的T细胞免疫学专业知识,为个性化癌症疫苗的设计创建了一条无缝管道。使用iVAX进行的协作研究表明,计算工具对于疫苗设计和疫苗功效研究的重要性。可能并鼓励开展其他合作,以评估现有疫苗针对新兴变体的潜在功效,预测对来自新兴传染病菌株的候选抗原的免疫反应以及设计可加快免疫原性的新型疫苗。
参考资料
- Front. Immunol., 07 April 2020 | https://doi.org/10.3389/fimmu.2020.00442。 Better Epitope Discovery, Precision Immune Engineering, and Accelerated Vaccine Design Using Immunoinformatics Tools。 https://www.frontiersin.org/articles/10.3389/fimmu.2020.00442/full
