【6.4.1】优化抗体表达的基本要点
抗体是生物医学研究以及诊断和治疗方法开发中广泛使用的实体。这些应用中的许多都需要大量抗体。然而,满足全球市场对抗体的这种不断增长的需求是突出的挑战之一。在抗体的供需之间保持平衡的需求促使研究人员发现了优化其表达的更好的手段和方法。这些策略旨在增加抗体的容积生产率以及降低相关的制造成本。近年来,由于引入了新的克隆策略,基因操纵技术,一系列细胞和载体工程技术以及发酵技术的进步,重组蛋白技术取得了重大进展。这些创新对抗体表达也非常有益。
抗体表达取决于多种因素的复杂相互作用,可能需要在不同水平上进行微调才能获得最大产量。但是,每种抗体都是唯一的,需要单独考虑和定制才能优化相关的表达参数。这篇综述对几种最先进的方法进行了全面概述,例如宿主选择,菌株工程,密码子优化,基因优化,载体修饰和工艺优化,这些方法被认为适合增强抗体表达。
一、简介
使用杂交瘤技术的单克隆抗体(mAbs)的出现是生物学研究中的一项重大且非常成功的突破,为科学家提供了一种产生具有独特特异性的抗体的方法。基因工程的进展使抗体生成技术进一步发展,它可以产生甚至超越大自然母亲设计的新型抗体形式,为抗体应用提供了一个全新的维度[1,2]。重组抗体(rAb)克服了与mAb生产相关的许多瓶颈,目前是生物制药行业中增长最快的领域之一[3,4]。强大的基因工程技术的发展为单克隆抗体向重组抗体的新生提供了动力,该技术提供了操纵抗体基因的能力,使产生具有所需构型,结合力和效应子特性的抗体变得可行,从而可轻松整合抗体。标签和融合蛋白可帮助检测,结合,纯化并增加其血清半衰期[3-8]。高通量筛选平台的可用性,易于遗传材料的保存,随着时间的推移抗体的稳定回收和可重复性,在廉价微生物宿主中易于生产以及专利方面增加了其商业价值[3-7]。
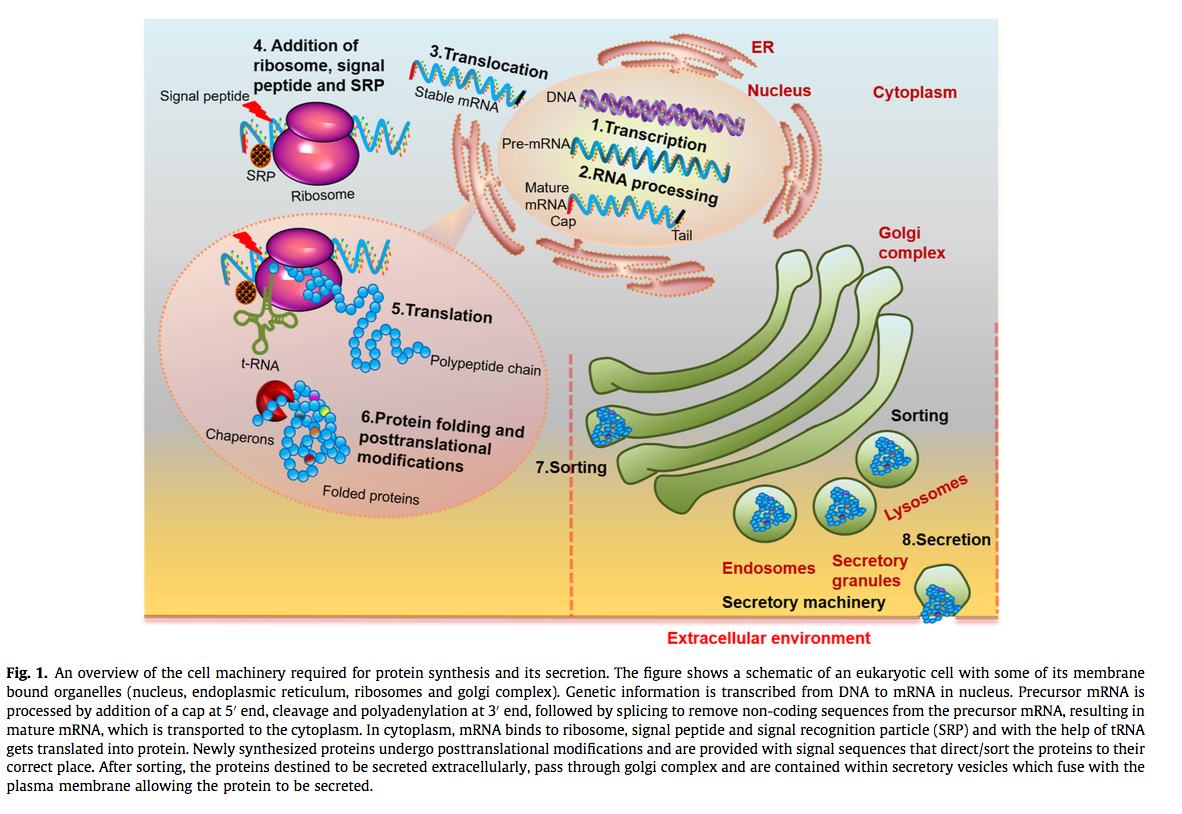
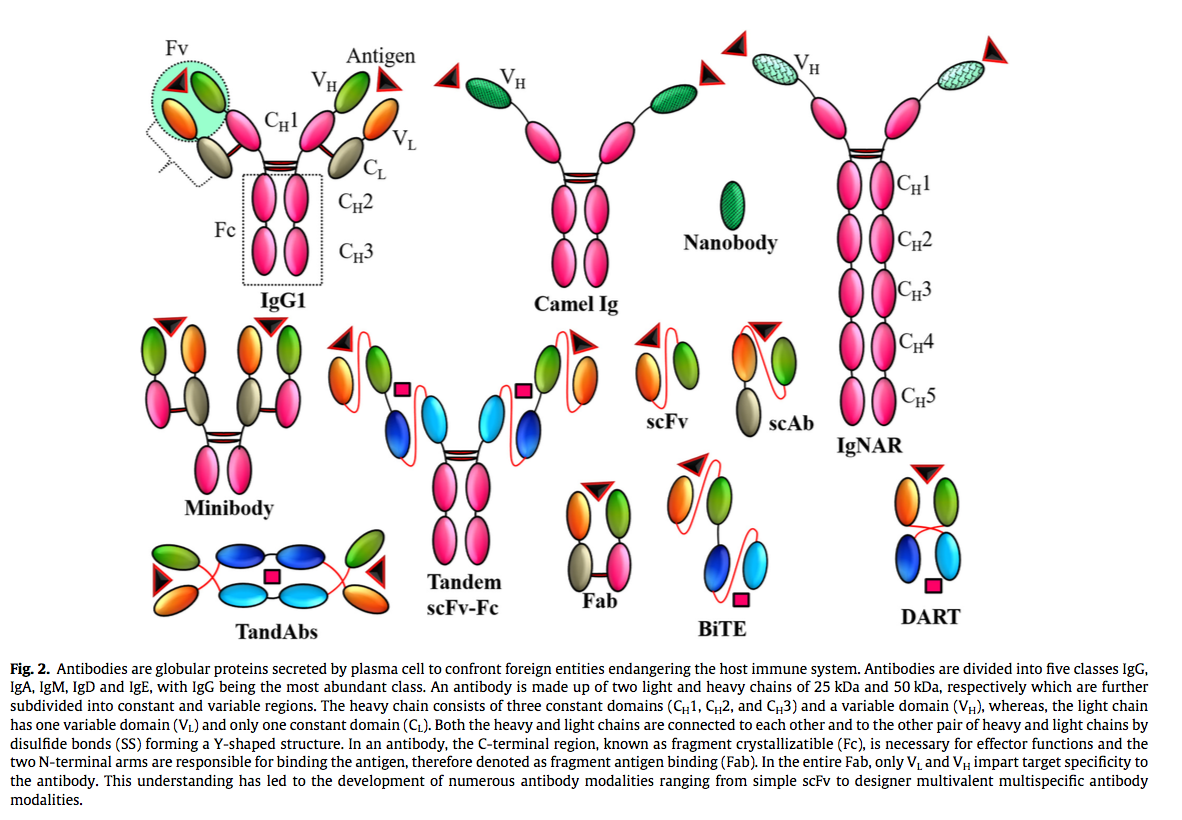
通过遗传信息从脱氧核糖核酸(DNA)转录到信使RNA(mRNA)并最终将mRNA翻译成蛋白质(图1),表达是一个多步骤过程。抗体通常是复杂的结构,需要复杂的细胞机器才能正确表达,折叠和加工。为适应不断变化的生物医学需求,对结构变异性的需求已经产生了复杂的抗体结构(图2),其具有单价,二价,三价和四价结合能力,分子量范围为12至150 kDa [9]。表达受抗体的大小,序列和形式,以及二硫键和二硫键之间的数量以及抗体总体功能所需的翻译后修饰的影响。这些出色的抗体设计的最佳功能表达和纯化是决定其在实际应用中的命运的关键因素。例如,由于表达产量低和产物不稳定性的问题,双特异性抗体长期处于休眠状态[3,10]。直到最近,双特异性抗体又使用现代分子生物学工具再次复兴,该工具有助于规避与其表达相关的挑战[3,10]。多数rAb基于免疫球蛋白结构的抗原结合单元,该单元对构象变化敏感,并可能导致表达的抗体聚集,因此不适合应用[11]。在没有通用平台可确保rAb的功能产量高的情况下,必须谨慎地分别优化每种抗体的表达和纯化条件(图3),以实现最大产量。这篇综述旨在总结不同的策略和最新趋势,以优化抗体表达。

二、表达宿主的选择
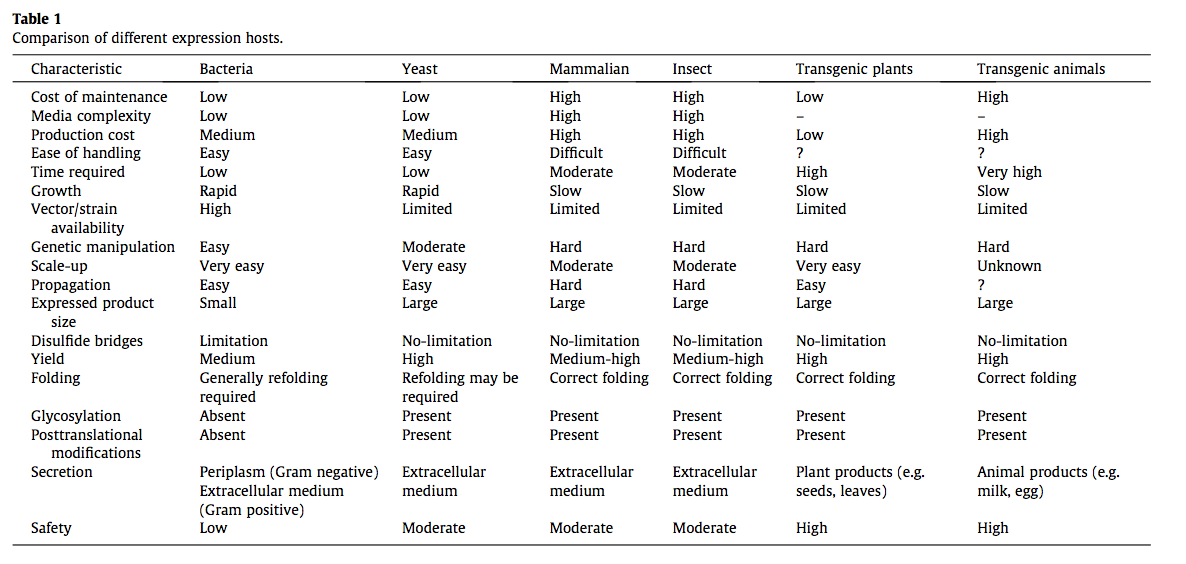
选择合适的宿主是获得最佳抗体表达的第一步。有一系列原核或真核宿主可用于抗体表达,它们具有各自的优缺点(表1)([4,12]综述)。哺乳动物细胞系(最常见的是CHO或HEK293)由于其低免疫原性和负责最佳折叠,分泌和翻译后修饰的内置细胞机制而优选用于表达治疗性抗体。但是,哺乳动物宿主具有某些缺点,例如文库大小较小,生产成本昂贵以及基因操作困难,这使微生物宿主成为生产rAb的最方便选择。 在微生物表达宿主中,毫无疑问,大肠杆菌仍然是研究环境中利用最广泛的表达系统[4,13]。它的流行是由于易于生产和处理,廉价的培养方法,可用的一系列载体和菌株,特征明确的筛选平台,快速的生产周期,没有特殊的培养基要求以及简单而完善的遗传学[4,13]。然而,由于氧化气氛和适当的折叠装置的限制,其表达具有复杂结构和二硫键残基的rAb的能力令人怀疑。据报道,除大肠杆菌外,恶臭假单胞菌[16]和盐生假单胞菌[17]用于生产rAb,其产量比大肠杆菌中的等效表达高2.5–4倍。革兰氏阴性细菌在周质中分泌蛋白质,蛋白质受空间和细胞机制的限制。通过延长革兰氏阳性菌中缺少外膜的rAb表达,克服了这一局限性,允许在细胞外表达。探索了多种革兰氏阳性细菌宿主,例如巨大芽孢杆菌[18],枯草芽孢杆菌[2],副干酪乳杆菌[19],猪霍乱弧菌[20,21]和长双歧杆菌[22],它们显示出高产量的抗体表达和分泌。
酵母是另一种常用的微生物表达宿主。酵母通过允许翻译后修饰具有适当的折叠和分泌机制,使原核系统的优势(生产周期短,成本低,易于遗传操作)与真核系统相结合,使其成为表达全长IgG和IgG的有利宿主。其他复杂的抗体形式。酵母能够进行高频同源转化,从而产生稳定的克隆,从而产生高抗体产量。巴斯德毕赤酵母是rAb表达的主要酵母表达系统[23]。用于rAb表达的其他酵母种类包括酿酒酵母,多形汉逊酵母,粟酒裂殖酵母,西方乳杆菌,乳酸克鲁维酵母,解脂耶氏酵母和乌斯季亚哥[24–27]。通常,酵母展示的文库小于噬菌体和核糖体文库[28]。还存在大的异源蛋白的低效率分泌,分泌蛋白的蛋白水解以及表达产物的不适当或过度糖基化等问题,这些问题可能会影响抗体功能。但是,菌株工程过程的最新进展已成功解决了许多此类问题,使酵母表达系统更适合于rAb的生产[29-32]。
研究其他表达rAb的宿主包括丝状真菌[33,34],藻类[35],原生动物[36],昆虫细胞[37,38],转基因植物[39,40]和转基因动物[41-43]。 ,这还为时过早,需要进一步发展。利用原核或真核转录和翻译机制的无细胞表达系统是小规模高通量快速表达功能性抗体的其他选择[44,45]。但是,这些系统对于大规模表达的功效仍然未知。
宿主的选择不仅影响表达,而且影响抗体的筛选,选择和最终应用。宿主相关的可表达性和表达诱导的宿主毒性在文库选择中起主要作用,导致在给定宿主中具有生长优势的结合剂分离,并导致低表达或对宿主有毒的结合剂在重复富集液中丢失-选拔周期。此过程称为“选择偏向”。各种研究观察到在改变表达宿主方面通过分离新抗体库的选择偏倚[46,47]。这导致了在多宿主表达中能够确定最佳表达和筛选策略的载体的发展[48,49]。
基因工程学的进步使研究人员具备了在体内表达抗体的能力,从而可以改变“宿主内动力学”。这些发展为一些新发现开辟了道路,这些新发现必将对涉及基于抗体的疗法和疾病控制策略的未来研究产生重大影响。使用生物安全表达系统在体内表达抗体有助于克服宿主的生理障碍,从而可以进行直接的治疗干预。例如,抗病毒乳糖体(生物安全副干酪乳杆菌表达的美洲驼重链抗体片段的可变域)[50]和转基因水稻中表达的抗轮状病毒纳米抗体[51]。最近,针对血锥虫表面糖蛋白的纳米抗体已在内共生苏达木中表达[52,53]。该研究表明,使用基于共生体的准转基因方法通过选择性靶向病原体的内部环境消除病原体是可行的,这表明表达宿主可以在确定rAb的质量和数量以及抗体应用中发挥重要作用。
三、应变工程 Strain engineering
对表达宿主遗传学的充分了解,再加上出色的基因编辑策略,例如锌指核酸酶,转录激活因子样效应核酸酶和/或CRISPR-CAS技术,[54-56]带来了无数机会系统地研究菌株修饰对抗体表达的影响。通过提高翻译效率,提高生长速度,帮助抗体重折叠并引入有利的转录或翻译因子,可以实现菌株的改良。通过利用诱变或利用DNA文库的遗传改变来对菌株进行工程改造,可以产生具有增强表达谱的改良表型。但是,由于蛋白质合成和加工各个阶段所涉及的任务很复杂,因此无法概括工程化对抗体表达的影响。需要针对每种抗体分别评估合理的靶标及其系统影响。例如,Warner及其同事[57]使用可追踪的多重重组(TRMR)并同时评估了成千上万的遗传修饰,以识别可影响与生长和代谢相关的各种性状的参数。最近,一群工人使用转座子诱变的酵母基因组DNA文库来生成啤酒酵母菌株,这些菌株显示出全长IgG抗体的不同表达特征[58]。使用高通量筛选技术选择高表达和低表达菌株,以鉴定影响抗体表达的因素。
工程菌株共同表达稀有密码子的转移核糖核酸(tRNA)可以显着增强抗体的表达。克隆扩增提供了另一种有希望的方法,用于产生高级细胞株,该细胞株可以通过使用氨酰基-tRNA合成酶/ tRNACUA对掺入非天然氨基酸来实现可编程的翻译后修饰或功能。例如,Lajoie等[59]通过用UAA替代UAG终止密码子对大肠杆菌进行了遗传编码,从而获得了改良的T7噬菌体抗性,释放因子-1(RF-1)游离表型,并具有可翻译非标准氨基酸的特性。 Mukai等[60]通过选择性消除大肠杆菌BL21菌株中273个UAG终止密码子中的95个,从而创建了一个不含RF-1的优良菌株而又不保证宿主细胞的繁殖力,从而进一步开展了这项工作。密码子扩展导致通过克服宿主细胞屏障,可以使用特定系统表达的蛋白质范围增加。
下游细胞机制,例如决定翻译后修饰,分泌,囊泡运输和易位的机制,对于反映细胞处理表达的能力至关重要。工程蛋白的合成和分泌途径导致表达增加[61,62]。蛋白质折叠不当会通过激活未折叠的蛋白质响应(UPR)来显着影响表达,后者会关闭翻译以最大程度地减少细胞负荷。为了防止表达的蛋白发生胞质和周质聚集,伴侣蛋白的共表达已被证明是一种有效的策略[63,64]。分子伴侣,如DnaK / DnaJ / GrpE,GroEL / GroES,ClpB,FkpA和Skp可有效防止抗体聚集,从而使表达受益[65-67]。具有二硫键的蛋白质(如IgG)需要特殊的分子伴侣来催化二硫键的形成。在筛选中,使用开放式无细胞合成(OCFS)系统的不同伴侣伴侣。 [68]确定二硫化物异构酶DsbC和脯氨酰异构酶FkpA为改善抗体表达的积极效应。同样,DsbA,DsbC和蛋白二硫键异构酶(PDI)的共表达也据报道可增加抗体表达[69,70]。
在生物系统中生产重组抗体的主要障碍之一是通过蛋白酶的作用降解分泌的抗体。一项涉及在小球藻中生产重组抗体的研究通过工程化多个蛋白酶缺陷菌株来抑制液泡蛋白酶和天冬氨酸蛋白酶对分泌抗体的作用来解决此问题。这抑制了分泌抗体的降解[71]。近来,哺乳动物细胞系已被用于大规模生产重组抗体。研究表明,UPR相关基因(例如CHOP / Gadd153和GRP78)与CHO细胞中重组抗体的产生相关。单独或与URP相关蛋白或内质网(ER)伴侣结合使用,CHOP的过表达是鉴定具有高产率功能性抗体的哺乳动物细胞系的有效方法[72,73]。虽然,在分子中共表达伴侣存在一些缺点,例如它可能对细胞系统造成的代谢负担,从而挑战了功能性抗体的产生[74]。
已开发出具有促进糖基化特性的细胞株,以协助分泌抗体的治疗功能。细菌和酵母的糖工程已经成功完成,为微生物宿主在治疗性抗体开发中创造了新的机会[75,76]。特别地,就生产人源化单克隆抗体而言,巴斯德毕赤酵母已成为关注的酵母,因为它显示出比酿酒酵母低得多的高糖基化曲线。通过敲除编码a-1,6-甘露糖基转移酶的基因并引入a-1,2-甘露糖苷酶,bN-乙酰氨基葡糖基转移酶I(GnTI)和UDP-GlcNAc转运蛋白来生产糖工程化的毕赤酵母菌株。含有复杂的人GlcNAc2Man3GlcNAc2聚糖的菌株[29,30,77,78]。 Potgieter等[76]开发了一种巴斯德毕赤酵母菌株,以分泌具有高度均一的N-连接聚糖的重组抗体,产生1 g / L的全功能IgG。
为了满足对重组抗体不断增长的需求,开发了能够表达高产率抗体的细菌,真菌,酵母和哺乳动物细胞系统(表2)。但是,只有通过进一步研究影响重组抗体分泌的各种因素并优化这些因素以生产稳定的异源蛋白质(例如抗体)。

四、密码子优化
基因表达是一个受控制的过程,在转录和翻译水平上涉及多个调节因子,影响整个表达过程。几个因素会影响基因表达水平,例如:
- 每个氨基酸的密码子使用频率,
- mRNA的5’端易折叠成稳定的二级结构
- mRNA的鸟嘌呤胞嘧啶(GC)含量
- 隐性转录的存在终止子,
- 核糖核酸(RNA)降解基序
- DNA重组位点(图1)[79]。
遗传密码的简并性导致氨基酸(蛋氨酸和色氨酸除外)由多个(2–6)个同义密码子编码。在给定的宿主中,并非所有密码子都以相同的频率使用,有些密码子在高度表达的基因(最佳密码子)中广泛使用,而有些密码子(稀有密码子)很少使用,这反过来反映了它们同源tRNA的丰度[80]。当目标基因(表达目的基因)中最佳密码子的频率与表达宿主显着不同,而不匹配宿主的调节翻译过程的tRNA时,就会出现密码子偏倚。
密码子偏倚影响表达的程度仍有待商,但很明显,密码子偏倚会影响翻译的几个方面,包括氨基酸插入的准确性,多肽折叠,mRNA序列和稳定性。 Messenger RNA序列决定了核糖体和蛋白质的结合,从而调节了影响蛋白质合成的整体剪接和翻译机制[81]。密码子还会影响核糖体随后沿称为“延伸”的mRNA的运动。伸长率取决于许多变量,具体取决于宿主物种,例如起始位点上是否存在最佳密码子,mRNA二级结构,密码子-核糖体相互作用,依赖于密码子或tRNA的变异,活性tRNA的数量,同源三元的存在,以及非同源和近同源三元络合物[82]。
考虑到DNA起源和非天然表达宿主之间的密码子偏倚,使用免疫宿主或杂交瘤产生重组抗体可能会在原核宿主中产生表达问题。密码子偏倚可以通过靶基因的密码子优化来适应宿主的tRNA库来解决,也可以通过修饰宿主以增加代表性不足的tRNA的可用性来解决[83,84]。 Sharma等[85]通过密码子优化鼠类单克隆抗体并将其在大肠杆菌中表达,单链可变片段(scFv)的表达增加了14倍。最近,Tran等。报道,在密码子优化后,菊花中scFv的表达增加了两倍以上[86]。可以使用在线软件(例如 Optimizer,Java Codon Adaptation Tool或GeneOptimizer)执行密码子优化。此外,可以携带几种稀有tRNA的补充基因的特殊菌株,例如BL21(DE3)-CodonPlus,BL21(DE3)-CodonPlus-RP,Rosetta(DE3),TunerTM衍生物。
五、基因优化 Gene optimization
抗体中的可变区包含来自后续VDJ重组和体细胞超突变的高度多样化的序列,从而赋予抗体分子以特异性和亲和力。这些不同的序列有时可能会损害rAb的稳定性,使其易于聚集并降低表达。针对改善/增强抗体生物物理特性的持续努力已导致鉴定出各种内在和外在因素,例如表面暴露的残基,可变区界面的疏水核心和最佳的VH-VL对, rAb的稳定性[87-91]。 Demarest及其同事[92]报道了通过突变Fv区域的11个残基,Fab的稳定性和功能性表达增加。另一项研究表明,在高特异性位置(VH中的28、30、31、32、33、35和VL中的24、49、50、51、52、53、56)处的氨基酸被带负电荷的氨基酸(天冬氨酸或谷氨酸盐)取代,不仅可以改善表达,还可以使抗体免于聚集[88]。抗体结构(构架区或互补决定区(CDR))中的某些氨基酸不利于其以rAb形式表达,导致产量低下,尤其是在原核宿主中。将这些氨基酸替换为有利的氨基酸可以改善抗体的表达。例如,据报道,通过替换VH结构域中的两个氨基酸,抗体表达增加了66倍[93]。同样,Ayyar等[14]和布坎南等[94]分别设计了兔scFv和治疗性抗体(MEDI-3617),以通过在抗体可变域中突变非规范的未配对半胱氨酸残基来克服表达和聚集问题。
有时,在文库构建阶段,VH和VL结构域的随机组合会导致体内进化和选择的天然配对丢失,从而需要其他工程/亲和力成熟步骤来优化所得rAb的亲和力和稳定性。这表明VH和VL相互作用在确定rAb的生物物理特性中的重要性。 Ewert等[90]测试了各种人类VH和VL组合,得出的结论是Vk3框架是最稳定的VL结构域,它们与IgHV1的结合在测试的可变域配对组合中产生了最高的可溶性产量。同样,Tiller等[95]确定了人类种系VH和VL区的使用频率,并确定了它们的配对频率。他们鉴定了36个固定的VH-VL构架对(包含12个不同的VH和15个VL基因片段(9 Vk,6 Vλ),具有出色的生物物理和表达特性,并将它们用于构建合成文库“ Ylanthia”。有时,复杂的抗体形式(包含多于两个多肽链)的表达可能需要调节单个多肽链表达的表达才能实现最佳组装和产量。Magistrelli等人[96]降低了lambda的表达。通过在序列中引入非最佳密码子来获得κ和λ链之间的最佳调节,从而使所得的kλ双特异性抗体的功能产量增加一倍。
糖基化还可以通过改变rAb的稳定性来影响其表达[97]。抗体在每条重链的CH2域中的天冬酰胺297上均具有N-连接的糖基化位点,在抗体效应子功能及其药代动力学特性中起着重要的作用。在某些情况下,在Fab区域也观察到糖基化。抗体糖基化是重要的翻译后修饰,在确定抗体构象和折叠中起关键作用,因此影响其稳定性和溶解性[75,98]。通过专门引入糖基化位点的糖工程抗体可以帮助恢复rAb中的最佳糖基化模式并稳定其固有特性。 Pepinsky等[99]通过同种型转换和CDR残基的诱变以及糖基化位点的改造,成功地将抗LINGO-1单克隆抗体Li33 mAb的表达从0.3 mg / mL提高到> 50 mg / mL。
表达宿主的翻译后机制不同,对表达的rAb的糖基化组成模式有重大影响。尤其是原核宿主,缺乏抗体糖基化所需的翻译后机制。 Lizak等[75]证明通过在scFv的连接子区域中设计一个糖基化位点,并在装配有空肠弯曲杆菌空肠弯曲杆菌N-糖基化机制的工程化大肠杆菌中表达它,可以在原核系统中获得糖基化的scFvs。 。糖基化显着提高了scFv的稳定性和溶解度,而又不影响亲和力,从而突出了基因优化在生产稳定且抗聚集的抗体中的重要性。
六、抗体格式化 Antibody Formatting
抗体的形式可以是抗体表达的决定因素。域的方向,接头的性质和标签的存在会影响重组抗体的表达[100],尤其是scFv。在scFv设计中,域顺序可以是VL-VH或VH-VL,连接子将一个域的3’端与另一个域的5‘端相连。多项研究表明,可变结构域的顺序以及连接子的长度显着影响了scFv或以scFvs为构建基团生成的rAb的产量;使产量提高几百倍[14,101–105]。域顺序不仅会影响表达特征,而且还会改变rAb的功能[103,106]。宿主相关因素也可能影响域顺序对rAb表达的影响[102]。
接头是rAb的关键成分,可能会影响其柔韧性,稳定性和抗原结合特性。张等[103]发现接头中氨基酸的长度和性质均可影响热稳定性和表达。各种具有不同长度和序列的肽接头已被用于构建rAb [103,107]。通常,包含甘氨酸和丝氨酸残基的组合的接头用于为所得rAb提供柔韧性和蛋白酶抗性。但是,这样的组合不能保证所有表达的rAb的最佳表达。噬菌体展示提供了一种强大的方法来识别和选择适合特定rAb设计/格式的功能性连接子[108]。特纳等[109]从噬菌体展示库中获得了6个接头,并注意到其中5个接头的scFv表达提高了5倍。同样,唐等[107]发现富含脯氨酸和精氨酸残基的接头提供了功能性scFv。域顺序或连接子对rAb稳定性和表达的影响可以归因于对可变域之间相互作用的影响,这些变量决定了表达的rAb的折叠和构象。
添加融合蛋白也被广泛实践以通过增强rAb的稳定性和溶解性来提高其产量。据报道,有许多融合蛋白,包括硫氧还蛋白(TRX),小的泛素样修饰剂(SUMO),泛素(Ub)和NusA,但谷胱甘肽S-转移酶(GST),麦芽糖结合蛋白(MBP),多组氨酸标签,诸如Flag,cMyc等抗原决定簇标签是最受欢迎的标签。抗体结构域的添加,例如免疫球蛋白的恒定轻链结构域(Ck)也被用作与scFvs的C端融合体,从而形成单链抗体结合域(scAb),以提高其表达产量[14,110]。最近,Kato和Hanyu [111]审查了大肠杆菌中抗兔IgG scFv表达的不同融合标签,发现DNA结合蛋白Zif268与scFv C末端的融合极大地改善了表达。选择融合蛋白时,有必要凭经验测试其对单个rAb的作用。理想的融合蛋白不仅会增强表达产物的溶解度并促进其正确折叠,而且还将在基于亲和力的应用中提供优势。
例如,HaloTag技术基于HaloTag之间共价键的形成而提供了功能蛋白质分析的优势。蛋白质融合标签和不同的合成化学配体。此功能有助于多种应用,例如纯化,蛋白质-细胞或蛋白质-蛋白质相互作用和蛋白质稳定性研究。尽管具有优势,但在某些情况下,融合蛋白还可以通过改变其生物学活性和/或导致较低的表达产量而对蛋白构象造成负担。因此,必须考虑融合标签在表达蛋白上的负担,并设计出从表达产物中去除融合标签的最佳策略(如果需要)。
通过改变结构域构型,接头或融合蛋白的性质来格式化抗体可以改善其表达,并且还影响其他参数,例如结合,选择和亲和力成熟。但是,抗体形式没有通用的规则可以保证最佳表达,因此每个rAb都需要单独研究以选择可以表达的最佳形式。
七、Vector modification
在任何生物系统中,稳定异源蛋白(例如重组抗体)的产生都受到所用载体的极大影响。载体应着眼于三个基本特征:
- 表达水平与基因整合位点无关,
- 表达水平与整合的转基因拷贝数之间的相关性
- 维持基因的能力。
随着时间的推移表达效率。总的来说,理想的载体系统应该能够有效转录,mRNA加工,RNA转运和主要mRNA转录物的翻译,从而能够产生稳定的蛋白质[112]。为此,开发了一系列载体系统(表3)。
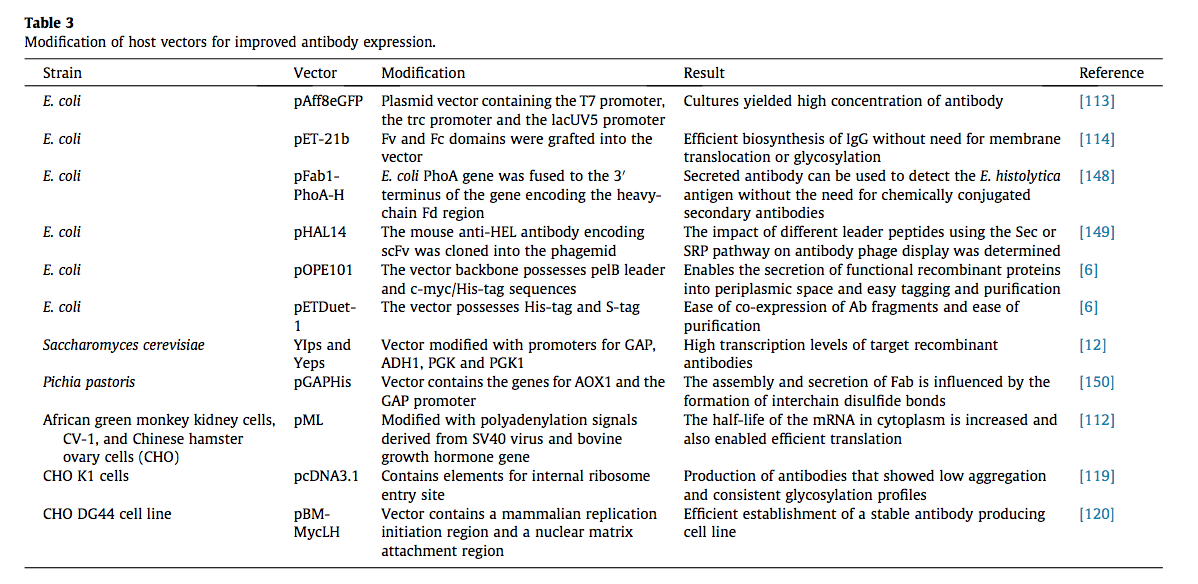
用于产生重组抗体的最常用的生物系统是细菌系统,例如大肠杆菌。与给定细菌一起使用的启动子的选择将对表达的蛋白质的完整性产生强烈影响。通常用于此目的的一些启动子是T7启动子,lac启动子,合成的trp启动子和trc启动子。 Tegel及其同事[113]使用整合到用于生产蛋白质的矢量中的T7启动子,trc启动子和lacUV5启动子进行了一项研究,测得的T7的产量高达6.6 mg / 100 mL,2.3 mg / trc分别为100 mL培养物和lacUV5培养物为12 lg / 100 mL培养物。罗宾逊等[114]证明了使用修饰的pET-21b载体将IgG进行有效的生物合成,而无需膜易位或糖基化,将先前鉴定的Fv和Fc结构域移植到其中。优化信号肽还可以通过影响抗体分泌而导致抗体产量的急剧增加[115]。 Koerber及其同事[105]通过将表达的抗体重定向至SRP途径而非常用的Sec途径,将scFab的表达提高了24倍。同样,在利用酿酒酵母作为宿主的同时,通过使用通常参与糖酵解途径的启动子(如3-磷酸甘油醛脱氢酶(GAP),醇脱氢酶1(ADH1),磷酸甘油酯激酶( PGK)和磷酸甘油酸激酶(PGK1)[116]。
哺乳动物细胞系被广泛用于抗体的生产,特别是用于治疗的抗体。稳定和增强哺乳动物细胞中初级转录物翻译的元件包括聚腺苷酸化信号,Kozak序列和中间序列。来源于SV40病毒和牛生长激素的聚腺苷酸化信号被假想以延长细胞质中mRNA的半衰期并实现有效翻译,是哺乳动物表达盒中最常用的元件[108]。使用源自F2A,P2A,E2A和T2A病毒的2A肽,将抗体产生所需的重链(HC)和轻链(LC)基因连接在单个盒上,从而在CHO细胞中高表达mAb [117] 。 Li等[118]利用不同版本的具有不同启动子和顺反子排列的单顺反子和双顺反子表达载体的版本进行了详尽的研究,以在HEK293T和CHO-K1细胞中产生重组人或嵌合IgG抗体。他们发现双顺反子表达构建体产生了在CHO细胞系中具有长期稳定性的抗体。同样,内部核糖体进入位点(IRES)元件用于在三顺反子表达载体中表达轻链和重链,从而导致抗体具有低聚集和一致的糖基化特征[119]。
基因的表达受其在基因组中相对于其正常染色体环境的位置的影响,这对于高水平和稳定的表达可能是不利的。这就是所谓的“位置效应”。可以通过使用绝缘子元件,普遍存在的染色质开放元件(UCOE),支架或核基质附着区域(A/MAR)以及稳定和抗阻遏元件(STAR)来克服位置效应,从而快速建立稳定的高产量克隆[120,121]。研究表明,通过正确利用融合蛋白,增强子元件或分子伴侣也可以增强抗体的表达。例如,Jäger等[122]通过优化载体的各个组成部分(例如启动子,前导序列,融合蛋白和终止信号)优化了用于scFv-Fc生产的载体,再加上工艺优化,可提供超过0.5 g / L的体积产量HEK293-6E中的rAb的数量。在另一项研究中,在单一开放阅读框(sORF)中与intein基因融合的抗体重链和轻链产生了单个mRNA转录物,翻译成一个多肽[123]。类似地,诸如抗凋亡蛋白或SV40病毒(SVLT)的大T抗原之类的元素可以通过增加细胞活力或将细胞生长期停在蛋白质生产的最佳条件下,作为表达增强剂。 Vink及其同事[124]通过将HEK293细胞与编码p33SVLT的增强质粒以及细胞周期抑制剂p21和p27共转染,获得了高达400 mg / L的rAb。抗体轻链和重链的组装以及抗体的正确折叠是总体细胞特异性抗体生产率的几个主要限制因素。用编码合适的伴侣基因的载体和编码抗体的载体转染细胞有助于其折叠和细胞外分泌[125]。
最后,考虑到载体在启动子,增强子,信号序列和表位标签中的重要作用,必须仔细选择它们的不同组成部分。高效的载体系统不仅可以提高产量,还可以简化抗体的加工和纯化过程。
八、优化表达参数
培养基,喂养策略,通气,温度和诱导剂浓度影响表达产物的最终产量(表4)。优化这些参数或其组合的研究表明,通过改善rAb的代谢,表达,折叠和/或分泌,功能性rAb的产量显着增加。使用具有不同碳源的培养基配方来优化rAb的生产。 Nadkarni等[126]比较了不同的培养基配方和诱导策略,发现与乳糖或IPTG诱导的葡萄糖基或甘油基培养基相比,Studier的乳糖自诱导培养基可提供更高的Fab产量。据报道,补充L-精氨酸,蔗糖和谷胱甘肽可提高功能性scFvs的产量,既可帮助其折叠,也可改善二硫键的形成[127,128]。 Allen及其同事[129]使用了小分子文库,发现属于芳香族羧酸,异羟肟酸和乙酰胺基团的某些小分子增强剂能够增加蛋白质表达。据报道,特定的小分子,如己酸异羟肟酸,丁酸钠和一些喹啉硫醚有益于增加抗体的产生[129-131]。但是,使用此类增强剂也会对细胞代谢过程产生负面影响,从而导致所得抗体发生不必要的修饰
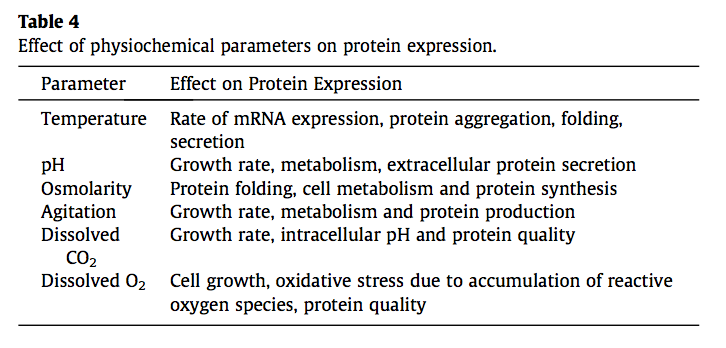
哺乳动物细胞用于治疗性抗体产生的增加使用已促使哺乳动物细胞系取得重大进展,并且与之保持同步的是,为开发针对这些细胞系的改良的培养基制剂(例如,完全化学确定的培养基)进行了大量努力。 通常会增加非动物来源的水解产物并优化饲喂策略,以改善生长和营养消耗,减少副产物积累并提高容积生产力[133]。 但是,由于化学成分复杂,其成分复杂,会导致批次间的差异。 由于培养基配方的影响完全取决于细胞,因此建议优先考虑所选培养基的代谢和营养消耗,以确保其适用性。 据报道,为哺乳动物培养物选择培养基成分和饲料策略的高通量方法可改善抗体表达[134,135]。
像培养基配方一样,通过优化理化参数(例如温度,pH,搅拌速度,氧气和二氧化碳含量)的工艺开发会极大地影响表达。表达的最佳参数取决于生产系统和单个抗体片段。有时,来自同一细胞系的克隆对特定条件的反应可能不同。 Kim和Lee [136]发现,由于最佳pH和温度要求的差异,源自同一亲本的两个CHO克隆之间抗体产生的差异。 Ukkonen等[137]比较了宿主菌株,培养基,诱导剂和通气对Fab表达的影响,发现在最佳通气条件下,大肠杆菌K-12和BL21菌株均可提供高产率的抗体。因此,要获得较高的表达率,有时需要同时优化多个参数,因为一次更改一个因素可能会很费力且繁琐。另外,修改单个因子可能会导致偏差,因为它假定所有参数都相互独立。可以通过因子设计,Taguchi方法和响应面方法等方法进行实验的统计设计(DoE),以通过识别多个因素之间的相关性并可靠地预测达到最佳表达的平衡条件来确定因果关系。一项研究评估了温度,pH和甲醇浓度对酵母表达的抗角蛋白scFv的影响,并通过使用DoE优化培养条件使产量提高了21倍[138]。同样,Akbari及其同事[139]报告说,通过使用DoE优化温度,诱导剂浓度和诱导时间,scFv产量提高了3倍。
除了个别抗体形式所表现出的差异外,不同宿主/载体系统的最佳培养条件也存在显着差异。 确定最佳培养基配方,培养条件,诱导剂浓度和诱导时间以实现最大生产率至关重要。 这些参数的简单优化使许多难以表达的抗体受益。 将DoE与自动化联系起来的高通量方法可以作为另一种替代方法,以消除多个变量,从而在短时间内为单个抗体选择最佳组合。
九、结论和未来展望
抗体在基础研究,色谱法和诊断学等各种应用中一直有多种用途[8,140,141]。另外,近来目睹了抗体作为治疗剂的令人兴奋的开发[3]。导致这种激增的主要原因之一是开发了先进的分子生物学工具,该工具有助于利用多种宿主机制开发一系列抗体形式。然而,这些技术中的大多数都无法提供具有成本效益和安全性的表达系统,该系统能够产生稳定且高产量的功能抗体,以达到制造水平,这是任何工业应用的前提[13]。因此,最近大量研究集中在改进克隆方法,制定密码子优化策略以及探索不同宿主和载体系统,以及定制单个变量以改善给定系统中的抗体表达(图3)
大量研究重新定义了开发最佳抗体表达系统的路线图(图4)。但是,即使经过多年的集中努力,仍然存在各种局限性,并且切实可行和可实现的重大改进。为此,最近的研究集中了许多途径(如本评论中所讨论)。然而,de Marco [4]讨论了取得突破性结果的关键限制因素,他建议也应发表该领域的负面结果,以便将来的研究可以通过不再走同一条路而从中受益。实际上,这将检查不必要的时间,资源,劳动力和金钱的浪费;同时集中精力可以导致开发出更好的方法。
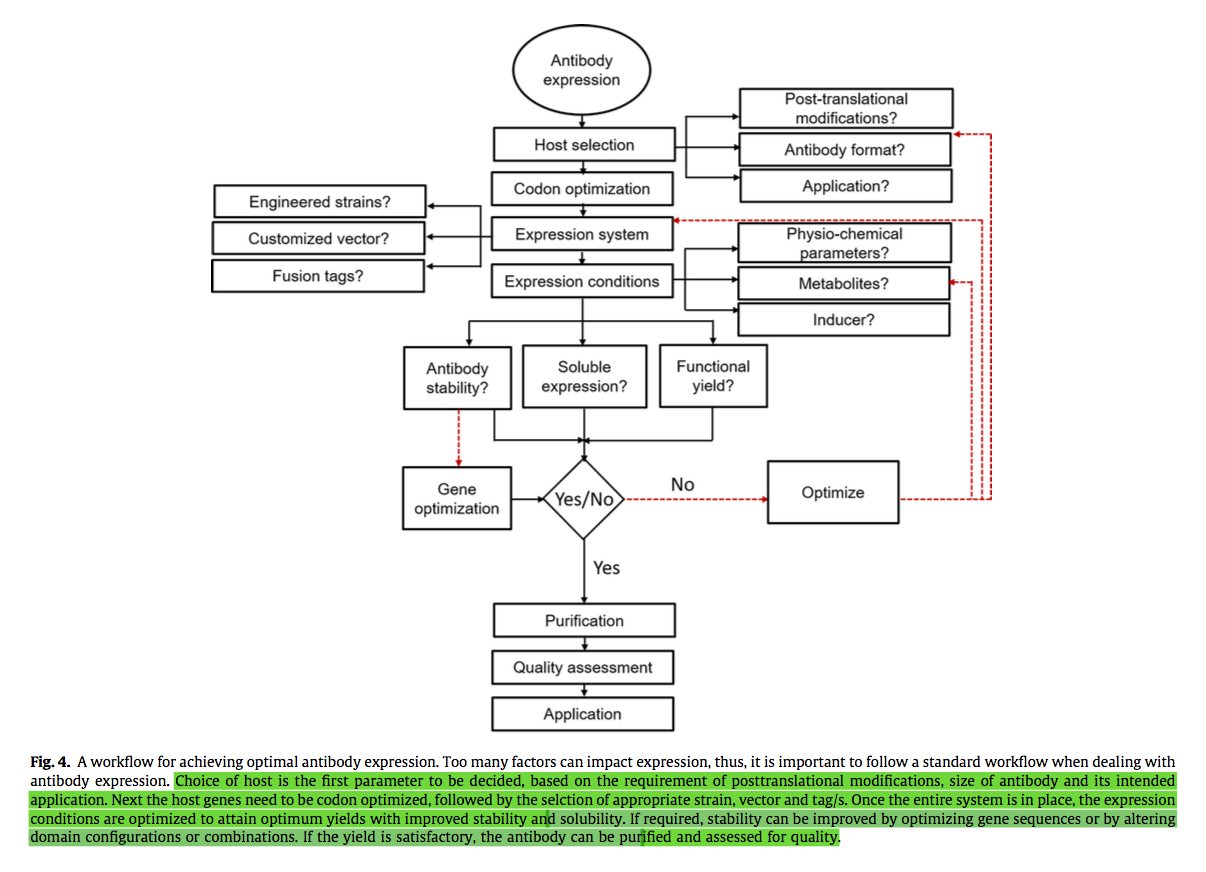
抗体表达是许多因素之间复杂的相互作用,因此,科学家极不可能找到能够大规模生产抗体的单一最佳系统[4]。然而,由于基因组学和蛋白质组学的进步,可获得的大量信息以及在未来将有更多的信息有望通过消除目前的障碍来引导研究人员在改善抗体表达方面迅速而实质性的进步[142]。虽然,这些改进是否也将有助于降低相关的制造成本还有待观察。
参考资料
- Ayyar, B. V., Arora, S., & Ravi, S. S. (2017). Optimizing antibody expression: The nuts and bolts. Methods, 116, 51–62. https://doi.org/10.1016/j.ymeth.2017.01.009
