【4.3.1.5】Tregitope肽--IVIG的活性药物成分
五年前,我们报道了在IgG重链和轻链中发现的几种调节性T细胞表位(现称为Tregitopes, regulatory T-cell epitopes)的鉴定和表征(De Groot等,Blood,2008)。当将这些Tregitopes体外添加至人PBMC时,它们会激活调节性T细胞(Tregs),增加转录因子FoxP3的表达并诱导CD4 + T细胞中IL-10的表达。现在我们已经表明,在多种不同的自身免疫性疾病鼠模型中,体内Tregitopes的共同给药可以抑制抗原特异性免疫应答,并且这种应答是由Tregs介导的。另外,我们已经表明,尽管这些通常是混杂的表位,但是单个Tregitope肽的活性受到HLA的限制。在这份简短的报告中,我们概述了Tregitopes在体内的作用,讨论了潜在的应用,并建议Tregitopes可能代表IVIg的“活性药物成分”之一。 Tregitope的应用可能包括目前几乎完全用静脉内免疫球蛋白G(IVIG, intravenous immunoglobulin G )治疗的任何自身免疫性疾病,例如慢性炎性脱髓鞘性多发性神经病(CIDP)和多灶性运动神经病(MMN),以及基因治疗和过敏,Tregitopes可能在其中提供诱导抗原特异性耐受的方法。
一、前言
在最近的工作中[1],我们发现了调节性T细胞(Tregs)的扩展和激活的重要触发器,调节性T细胞是免疫球蛋白G(IgG)框架序列中包含的T细胞表位。进一步的研究表明,这些肽是天然的T调节细胞抗原决定簇(Tregitopes),可以作为治疗(静脉内免疫球蛋白或IVIG)时至少部分解释多克隆免疫球蛋白的耐受诱导作用。 Tregitopes的主要特征是:
- 刺激CD4 +,CD25hi和FoxP3 + T细胞;
- 在抑制试验中抑制了效应T细胞对其他抗原的应答;
- 与体内和体外T细胞IL-10的产生有关[1]。
随后,已证明Tregitope肽可在多发性硬化症(EAE),过敏和哮喘小鼠模型中复制IVIG的作用,证实了我们的主要观察结果[2-4]。与其固有的免疫抑制特性一致,在完全或不完全的弗氏佐剂(CFA或IFA)中施用的Tregitope肽,可抑制对共同施用的抗原的免疫反应,但本身不具有免疫原性[5]。
虽然Tregitope肽与靶抗原共同给药可有效抑制抗原特异性免疫反应[6],但Tregitope肽本身在动物模型中也具有特别的活性,如果它们是在炎症的急性期给予的话。例如,在糖尿病发作时,在IFA中配制的Tregitope肽以单次剂量(腹膜内)递送给NOD小鼠,有效抑制了58%的小鼠的糖尿病25周[6]。在美国糖尿病与消化与肾脏病研究所(NIDDK)进行的严格而独立的NOD研究中,Tregitotope肽是六个测试中唯一显示出“显着趋势”的新颖疗法;三只糖尿病小鼠完全缓解,所有这些小鼠都属于Tregitope肽治疗组。未测试其他疗法(例如DT22669(DiaKine),Aralast NP(Baxter Healthcare),ISO-092(Feinstein医学研究所),Celastrol(Pi和Pi技术)和PGC-GLP-1(PharmaINCorporation))导致在这种侵略性糖尿病模型中使用Tregitope肽可延长病情[7]。此外,在TNBS(2,4,6三硝基苯磺酸诱导的结肠炎)治疗前十天在腺相关病毒(AAV)中递送的拟变体肽,在这种自身免疫疾病模型中足以抑制炎症性肠病(并诱导Tregs迁移到肠道)。。
二、Tregitopes:它们是什么?
2.1 天然和诱导性调节性T细胞及其耐受性 Natural and Induced Regulatory T Cells and Tolerance
越来越清楚的是,CD4 + CD25 + FoxP3 + Tregs是免疫调节的重要组成部分[9]。 具有中等T细胞受体亲和力的自身反应性T细胞,可以逃避胸腺中的缺失,从而在循环中作为“天然”调节性T细胞(nTregs)起作用[10]。 文献中描述了两个不同的Treg亚型:
- 针对自身表位的天然nTregs,通过在胸腺中的高亲和性选择产生,
- 以及可诱导的iTregs,它们是在外周刺激后衍生自常规(CD4 +,FoxP3-)T细胞的[ 11、12]。
nTregs可以通过细胞因子依赖性和非依赖性机制诱导常规T细胞向iTregs的转化,这一过程称为传染性耐受[13,14]。
据推测,自体蛋白质含有nTregitopes。 但是,这些映射(mapped)很少。 免疫球蛋白G数十年来一直显示出致耐受性,并且许多先前的出版物都暗示了IgG恒定域中调节或“抑制”表位的潜在存在,无论其位于恒定(Fc)还是结合区(Fab) 。 例如,Baxevanis等描述了定位于CH2区域的Ig Fc的耐受作用,与几个Tregitopes的位置一致[15]; 从抗独特型肽的Fab区域分离的肽(与随后鉴定的Tregitopes重叠)抑制了人类和小鼠的系统性红斑狼疮[16、17]; Warnke等人显示了一个来自高度保守的J区构架的肽, 在抑制剂试验中诱导Tregs扩展和抑制免疫反应[18]。
我们在单克隆抗体的发展[19,20]的临床前阶段进行免疫原性研究了一系列客户端(clients )。使用现在包含在ISPRI工具包[20]中的免疫信息学工具(EpiMatrix [21]),我们扫描了人IgG的恒定结构域,发现免疫球蛋白G的这些和其他区域包含推定(putative )的表位,这些表位预计会结合多个HLA和HLA在现有的IgG序列数据库中高度保守。我们假设它们将用于诱导Treg,而不是T效应T细胞,这可以解释为什么某些含有“外源”(胸腺发育中未见)序列的单克隆抗体可能不会产生免疫反应。这些Tregitope肽是否诱导nTregs或iTregs(周围的,可诱导的Tregs)或两者,还有待确定。但是,我们注意到,尽管含有由新序列组成的高变序列而可能显得“外来”,但含有 Tregitopes 完整补体的单克隆抗体不太可能触发免疫反应[22]。
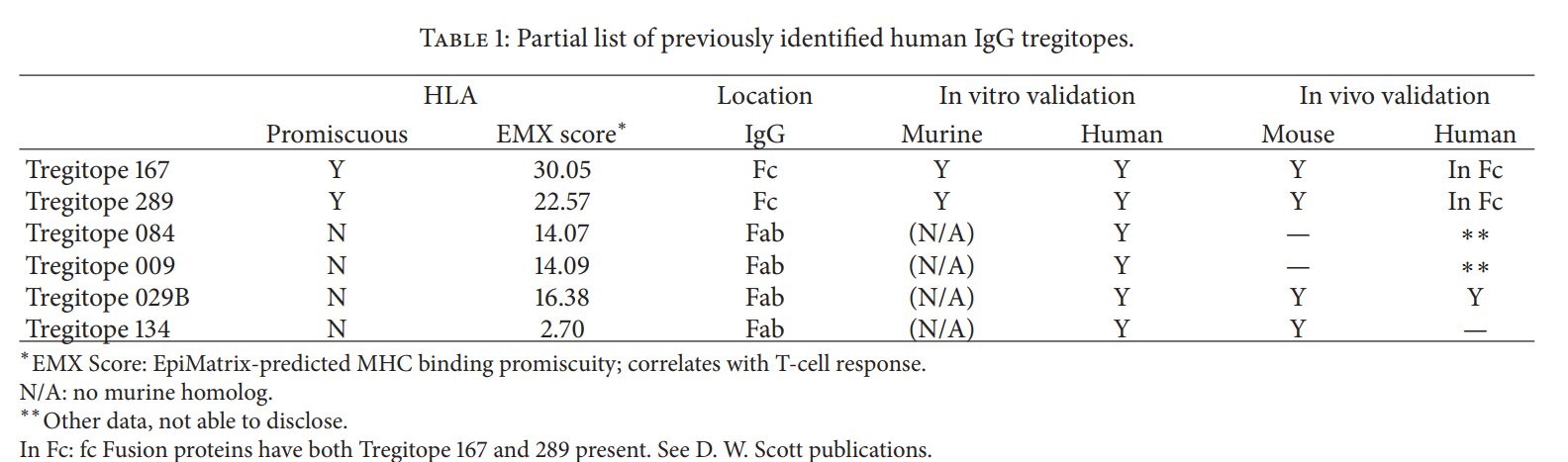
2.2 在IgG,Fab和Fc中发现了Tregitopes
如表1中所示,Tregitopes是混杂表位(如EpiMatrix所预测),位于IgG的Fc和Fab区。相反,在其他抗体同种型(IgE,IgA和IgM)中找不到Tregitopes。有趣的是,在Golan和Borel进行的对半抗原耐受性的开创性研究中,发现IgG而非IgM诱导了耐受性[23]。 Scott等人已广泛描述了对IgG Fc缀合抗原的耐受诱导。 [24–26]等[27],他们非常清楚地证明了II类HLA参与其中[28],并且该作用不需要Fc受体结合[29],这支持了我们的假设,即存在诱导耐受HLA II类限制的Tregitopes。如上所述,在IgG Fab中也发现了Tregitopes,这可以解释为什么Fab在诱导Tregs方面与IgG一样有效[30]。 Tregitope假说与Anthony等人的工作不同。 [31]认为IVIG诱导的耐受性是通过唾液酸化的Fc介导的,该唾液酸化的Fc通过凝集素受体SIGN-R1或DC-SIGN启动抗炎信号传导级联。然而,Tregitopes可能解释了与DC-SIGN结合的重要性,因为表面分子将结合的抗原直接运输至树突状细胞中的II类加工和呈递途径。
2.3 Tregitopes是否是IVIG的“活性药物成分(API)”?
IVIG 的作用归因于各种各样的机制(图1)。其他机制包括免疫复合物的形成[32]。唾液酸化的Fc与新型巨噬细胞受体DC-SIGN的相互作用[33]; Fc受体的阻断导致抗自身抗体的清除[34];通过抗独特型相互作用进行免疫调节[35];抑制补体介导的组织损伤[36];白细胞和内皮细胞直接调节细胞因子的表达;抑制超抗原介导的T细胞活化[31,37,38];和nTregs的诱导[11]。最近显示,IVIG与调节性T细胞轴的调节,IL-17的减少[39]和Tregs的抑制功能的增强有关[40]。在Massoud等人的最新研究中,IVIG对Treg的诱导显示依赖于IgG与称为DCIR的表面受体的结合,然后是内在化和加工[41]。这些观察到的许多效应均与拟议的Tregitope作用机理一致,因为Tregitopes是由IgG内在化和加工产生的肽,并与现有Treg的扩增和iTreg的诱导有关。 IgG的内在化(来自IVIG),在MHC II类背景下的Tregitopes呈递以及Tregitope特异性Treg的扩增将与最近的观察结果一致, IVIG的使用可以在体内,动物和人类体内诱导Tregs的扩增和IL-10的分泌。

3.最近的Tregitope研究概述
3.1 拟议的行动机制 Proposed Mechanism of Action
自2008年首次描述Tregitope以来,我们大大提高了对Tregitope作用机制的理解,得出了以下工作假设:
-
Tregitope效应取决于抗原呈递细胞(APC)和主要组织相容性复合物(MHC)II类介导的T细胞呈递
-
Tregs识别在MHC II中呈递的Tregitopes并被激活
-
这些激活的Tregs产生IL-10,并与APC相互作用以增强耐受性的发展
-
这些致耐受性的APC和/或Treg对邻近的抗原特异性效应T细胞起作用,以抑制其效应反应并诱导抗原特异性Treg。
我们小组和合作者发表的有关Tregitopes的研究证实了所提出的机制,包括体内研究,其中一些在第4节中进行了总结。
3.2 EAE中Tregitopes与IVIG的比较
在先前回顾的单独的体内和体外研究中[4],我们与Khoury和Elyaman实验室合作,在多发性硬化的EAE模型中比较了Tregitope肽治疗与IVIG。体内研究评估了IgG衍生的Tregitope的能力。 肽产生对MOG35-55表位的抗原特异性适应性耐受诱导。 在该研究中,小鼠通过MOG免疫进行了预致敏。 建立了EAE疾病并用盐水中的IVIG或人IgG Tregitope肽167和289治疗[4]。 在体外和体内观察到Tregitope肽对MOG35-55表位的免疫应答具有耐受性。 这些结果与Legge等人先前的报道一致。 [44]显示具有多种硬化症抗原的IgG融合蛋白可诱导Tregs。
3.3 Tregitope肽可抑制CD4 + T细胞反应,并且本身不是免疫原性的
在最近的一篇论文中,我们证明了Tregitope肽即使在用有效的佐剂(例如IFA或CFA)乳化时也不具有免疫原性[5]。 此外,在体外重刺激条件下,将Tregitope肽与IFA或CFA一起体内给药不会诱导Th1或Th2细胞因子表达。 我们通过使用B细胞通过OVA编码转运Tregitope肽来研究耐受诱导。 当B细胞用OVA和Tregitope肽脉冲并转移到幼稚小鼠中时,我们发现对OVA的细胞和体液免疫反,应由于其诱导Treg的能力以及在强佐剂的情况下缺乏免疫原性而受到抑制[ 5]。
3.4。 Tregitope诱导的Treg也可调节CD8 + T细胞反应。
针对病毒衣壳蛋白的免疫应答是将AAV用作人类基因转移载体的主要安全问题。使用Tregitope肽,我们表明有可能在体外调节CD8 + T细胞对几种病毒抗原的应答。用Tregitope肽和病毒表位肽孵育外周血单核细胞会触发CD4 + CD25 + FoxP3 + T细胞的增殖,从而抑制以抗原特异性方式杀死载有MHC I类抗原的靶细胞, 通过需要细胞间接触的机制。用表达衣壳的腺病毒载体免疫后,编码融合到Tregitope肽的AAV衣壳结构蛋白的构建体的表达导致针对AAV衣壳的CD8 + T细胞反应性降低。这伴随着脾脏中CD4 + CD25 + FoxP3 + T细胞频率的增加和注射组织中炎性浸润的减少。这项研究证明了使用Tregitopes调节CD8 + T细胞对抗原的反应性的可行性。
四、结论
4.1 Tregitope肽可以取代IVIG吗?
IVIG是来自10,000或更多捐赠者的血液汇集产品。与IVIG给药相关的许多不良反应(AE)是轻度和短暂的,包括头痛,潮红,全身乏力,发烧,发冷,疲劳,恶心,呕吐,腹泻,血压变化,心动过速和过敏反应。罕见但更为严重的不良事件包括急性肾功能衰竭,血栓栓塞事件,皮肤相关影响,包括毒性表皮坏死溶解和无菌性脑膜炎[45]。这些作用中的许多已归因于多克隆免疫球蛋白混合物中单个抗体的靶向功能。但是,一般而言,IVIG被认为是相对安全的。因此,寻求替代方案的主要动机是经济的(以降低患者和保险公司的成本),或者是为需要IVIG的功能抗体成分预防感染的原发性免疫缺陷患者保留IVIG的供应。 Tregitopes可以部分解释IVIG发挥其致癌作用的机制。如果这些作用是由Treg介导的,那么Tregitopes可以作为自身免疫疾病的替代IVIG,后者可能更安全(由于缺少功能性抗体成分)并且更有效。
如果IVIG对Tregs的诱导可以归因于Tregitopes,那么目前仅使用IVIG治疗的许多自身免疫性疾病(标签上和标签外)可能是仅包含Tregitope肽的免疫调节制剂的合适靶标。以IVIG为主要免疫疗法的疾病的两个例子包括慢性炎症性脱髓鞘性多发性神经病(CIDP)和多灶性运动神经病(MMN)。引入Tregitope肽作为IVIG的替代品,也将对免疫调节疗法对IVIG的需求产生重大影响[11、43、45]。 IVIG还可以在免疫性血小板减少性紫癜(ITP),川崎综合征(KS),多肌炎,皮肌炎,神经系统综合征(如格林-巴利和CIDP),严重的类固醇依赖型哮喘以及其他许多疾病中迅速有效地发挥作用[46,47] 。 Tregitope肽疗法可能是有时用于这些疾病的全身免疫抑制疗法的一种有吸引力的替代方法。
4.2 其他Tregitope应用
用确切定义了活性药物成分(API,Active Pharmaceutical Ingredient)的治疗产品代替作用机制不确定的捐赠者血液来源的产品,将代表自身免疫疾病治疗领域的一大进步。此外,由于Tregitopes似乎能够诱导抗原特异性耐受性(诱导的Treg对共同施用的蛋白质具有特异性),因此将Tregitope疗法适应特定自身免疫疾病的可能性将为临床应用带来额外的优势(图2)。可以想象使用Tregitope肽和过敏原蛋白或肽的组合来进行过敏原特异性治疗,以及治疗自身免疫性疾病(例如糖尿病),这将依赖于Tregitope肽和糖尿病抗原的共同给药。专门产生MOG反应性Treg的想法对于多发性硬化症的治疗也特别有吸引力,根据我们在EAE小鼠模型中的数据,我们认为Tregitope肽可诱导抗原特异性适应性耐受。 Tregitopes在蛋白质治疗,动物健康以及血液因子或酶替代治疗中也可能具有更广泛的应用。
许多自身免疫性疾病的治疗依赖于免疫抑制治疗,而不是旨在恢复效应子和调节性免疫反应之间平衡的治疗。 鉴于Tregitope肽似乎在小鼠模型中诱导了适应性耐受,因此,除了测量反应持续时间,所需剂量,安全性和安全性外,接下来的考虑是评估最佳制剂并确定耐受诱导的最佳时间过程。 治疗的毒性(相对于其他免疫反应),以及最佳的制剂/给药途径。 我们的初步研究表明,适应性耐受诱导可能会触手可及,这使我们寄希望于我们为开发有效的基于免疫疗法的自身免疫性疾病方法的正确道路。
讨论
Tregitopes 抑制免疫原性,且Tregitopes在Fc区域,是不是我只用包含Tregitopes的Fc就可以去除免疫原性呢? 这显然不科学呢。
参考资料
- Clin Dev Immunol. 2013; 2013: 493138. Tregitope Peptides: The Active Pharmaceutical Ingredient of IVIG?
