【6.6.2】在计算机上选择要开发的治疗性抗体(粘度/清除率/化学稳定性)
单克隆抗体越来越多地用于治疗慢性疾病,其中优选皮下递送途径以实现自我施用和在家使用。 为了通过小体积(约1 mL)将高剂量(几百毫克)递送到皮下空间,mAb溶液需要具有低粘度。 相应地,需要足够的化学稳定性来获得足够的保质期,并且需要正常的体内清除才能降低给药频率。 我们提出了一种计算机工具,可快速评估mAb的非典型行为(高粘度,化学降解和快速的血浆清除率),可根据序列和/或结构衍生的参数对其进行简单预测。 此类分析将大大提高成功将基于mAb的疗法有效地应用于临床开发并最终使患者受益的可能性。
一、摘要
为了使mAb成为可行的治疗剂,必须将它们配制为具有低粘度,化学稳定性和正常的体内清除率。我们通过观察多达60种IgG1同型抗体的相关性来探索这些特性。出乎意料的是,我们观察到与可从抗体序列以及单个抗体分子的分子动力学模拟获得的简单物理特性之间的显着相关性。
- mAb的粘度随疏水性和电荷偶极子分布而大大增加,而随净电荷而降低。
- 快速清除与某些互补决定区的高疏水性以及高或高负净电荷相关。
- 色氨酸氧化引起的化学降解与色氨酸残基的平均溶剂暴露时间有关。天冬氨酸异构化速率可以通过分子动力学模拟确定的溶剂暴露和柔韧性进行预测。
这些研究应有助于在早期发现期间更快速地筛选和选择单克隆抗体候选物。
使用基于mAb的疗法治疗某些慢性疾病(例如类风湿性关节炎)需要通过s.c途径,病人在家中使用,自我管理(1)。将少量小剂量(〜1 mL)的数百毫克活性药物输送到s.c.,因此,需要一种含有高浓度mAb的液体制剂(1、2)。因此,重要的临床单克隆抗体候选药物必须符合以下标准:
- 低粘度的可注射溶液(高粘度的溶液难以生产和使用,并且可能会很痛苦)
- 使溶液中的化学/物理降解降至最低,从而保持功效和安全性;
- 体内清除率正常,避免多次注射和/或更频繁地给药(3,4)。
必须尽一切努力筛选出具有理想理化和生物学特性的先导mAb候选物。将计算机计算工具与实验方法结合使用,将能够快速筛选出大量的单克隆抗体候选物(5-7)。
在本报告中,我们描述了计算机筛选方法,可帮助选择有关粘度,食蟹猴体内清除率(人类清除率的相关临床前模型),Trp氧化和Asp异构化的单克隆抗体候选物。我们表明,使用从包括分子动力学模拟在内的序列和/或结构中提取的最佳参数,可以预测单克隆抗体的理想属性,从而能够进行候选前导选择。
二、黏度 Viscosity
在互补决定区(CDR)序列或Fv结构域上有很大不同的mAb,在相似的剪切速率条件下表现出多种粘度-浓度曲线(图1A)。认识到对于相似同种型(在本例中为IgG1)的mAb,可变域Fv(及其内部的CDR)可能在定义导致粘度差异的分子间相互作用中起关键作用(8,9),我们着手确定可以提取哪些参数来捕获疏水性和静电性元素(10、11)。最近已经推测,这种相互作用可能产生分子缠结,从而导致粘度增加(12)。我们只关注序列,因为它提供了最简单的数据生成和分析方法。但是,我们注意到,下面讨论并根据序列计算的任何参数也可以很容易地从结构中计算出来(图S1和S2)。如图所示(图S1和S2),基于序列的计算与基于结构的计算相关。

计算的参数为:
- 在给定pH(本研究中为pH 5.5)下Fv的净电荷,
- 在pH 5.5时VH和VL结构域之间的Fv电荷对称参数(FvCSP)
- 疏水指数(HI)的Fv。
净电荷可能会导致排斥性相互作用,而FvCSP和HI可能会导致有吸引力的相互作用。 FvCSP参数表示VH和VL域的净电荷状态相似。我们假设缺乏电荷对称性,即相反的净电荷(负FvCSP),为Fv域提供了通过偶极子(dipole-like)相互作用或与mAb上存在的另一个电荷补丁与另一个Fv域相互作用的机会(11, 13)。因此,预期更大的负FvCSP值将导致更强的吸引力相互作用。我们认识到,实际的结构构象可以以不被序列定义的方式捕获的方式分布电荷不对称性。但是,我们的基于序列的计算为缺乏电荷对称性提供了合理的第一近似值,而电荷对称性则相对容易计算。
对于一组14种不同的mAb,我们检查了这三个参数与实验粘度值之间的相关性(在pH值为200的200 mM精氨酸缓冲液中以180 mg / mL测得)(图1 B–D)。在Fv电荷和粘度之间(Pearson的r = -0.8)以及在FvCSP和粘度之间(Pearson的r = -0.8)观察到相当的相关性;但是,HI和粘度之间的相关性有所减弱(Pearson的r = 0.6)。显然,静电相互作用在调节粘度中起主要作用,而疏水性在这些溶液条件下对这些mAb的总体粘度的贡献较小。 FvCSP与粘度之间的更强相关性表明,VH和VL结构域之间的电荷不对称可能在调节粘度中起作用。
接下来,我们使用主成分回归(PCR, principal component regression)分析来提供粘度预测模型。 在25°C下180 mg / mL的粘度用作自变量。 Fv电荷表示为q,FvCSP表示为qsym,HI表示为ϕ作为因变量。 表S1中显示了计算出的参数的详细信息。 将在180 mg / mL下观察到的各种mAb的实验粘度值与通过最佳拟合方程式获得的预测粘度值以及90%CI绘制在一起(图1E)。 最佳拟合方程描述为

该系数对于该缓冲系统和各自的蛋白质浓度是特定的。与系数相关联的SE在系数旁边的括号中表示。总体而言,观测值和预测值之间的强相关性(Pearson r = 0.9)和180 mg / mL时的平均绝对误差为7±9 cP,表明该模型在预测粘度值时效果很好。为了进一步测试模型的有效性,我们使用了留一法交叉验证(LOOCV)方法。进行PCR分析,同时保留一个mAb,并使用其余mAb作为训练集;然后将所得的最佳拟合方程式用于预测遗留mAb的粘度;然后针对每个mAb重复这些步骤。观察到很强的相关性(Pearson r = 0.8),在预测的粘度值和观察到的粘度值之间平均绝对误差为9±10 cP(图1F和表S1)。基于此分析,我们显示出当前的训练集和所得的输出模型(方程式1)可以预测IgG1同种型mAb的粘度值。
使用序列衍生的理论参数,通过PCR回归分析获得的模型方程可有效地预测涉及IgG1同型抗体的蛋白质缓冲系统的粘度。只要可以识别有助于粘度的关键理论参数,该方法就可以扩展到其他缓冲系统以及其他IgG亚类。根据缓冲液系统的类型和溶液条件,可能需要包括其他参数,例如与离子结合有关的参数,以生成有效的预测模型。
三、Clearance
相似同种型内的抗体在人和食蟹猴(已建立的临床前模型)中的血浆清除率差异很大(14)。一些研究表明,这种差异与pI或序列中的特定突变相关(15、16)。但是,没有明显的趋势报告。清除速度加快的根本原因归因于体内单克隆抗体的脱靶/非特异性结合(14),大概是通过疏水和/或静电相互作用。我们着手探讨是否任何序列特性都能预测Cyno清除率的差异。我们假设可变域中此类特性的任何极端情况(例如pI,电荷或疏水性)都会转化为抗体,从而表现出更快的Cyno清除率。根据先前公布的数据,在Cyno猴子中,每天≥10 mL / kg的清除率值(即,在给定的时间单位内从给定体重的血浆中清除的药物量)被指定为更快的清除率,每天<10 mL / kg的值指定为正常清除率(14)。
在最大给药剂量(10至100 mg / kg)下,评估了一大批IgG1 mAb(61 mAb)的Cyno清除率。如先前报道(14),在计算的mAb pI或HI与清除率之间未观察到明显的相关性(图S3 A和B)。除了评估整个mAb的分子特性,我们的下一步是检查可变域Fv的差异是否在清除率方面更具区分性。为此,计算了一定pH范围(pH 5.0-7.5)中的Fv电荷,并将其与清除率值进行比较。涵盖了更宽的pH范围,包括生理pH和内体pH(抗体清除涉及通过pH低至pH 5-6的内体环境中的FcRn拯救)。此外,检查了某些CDR的疏水性是否与清除相关,而不是总的CDR或Fv疏水性更好。
为了简化我们的分析,我们提供了一个14 mAb的测试装置,与参考文献14中使用的相似,首先用于覆盖clearance 的整个范围(图2A)。训练组中的单克隆抗体按清除率值的降序排列。我们评估了允许我们将两组mAb分开的标准(每天≥10vs. <10 mL / kg)。对计算得出的参数进行检查后发现,清除速度更快的mAb倾向于在三个特定CDR(LC CDR1,LC CDR3和HC CDR3)之间具有较高的疏水性。这三个CDR的HI值的计算和用于简化进一步的分析。快速清除组中mAb的平均HI总和显着高于正常清除组中mAb的平均HI总和(分别为3.9±1.4 vs. 2.5±0.7,P = 0.045,未配对t检验)。关于Fv电荷,我们注意到在pH 5.5(恰好在内体pH范围内)时,所有六个具有正常清除率值的mAb往往具有0.4至6.1的电荷值,而8个mAb中有五个更快清除的charge超出此范围。我们注意到,在区分快速清除mAb时,CDR的电荷和选择性HI彼此互补,即快速清除组中电荷值在0.4和6.1之间的那些mAb具有相对较高的HI总和值。此数据分析表明,某些CDR的高疏水性或Fv电荷值的极高(高负或高正)都可以预测单克隆抗体具有更快的清除率。
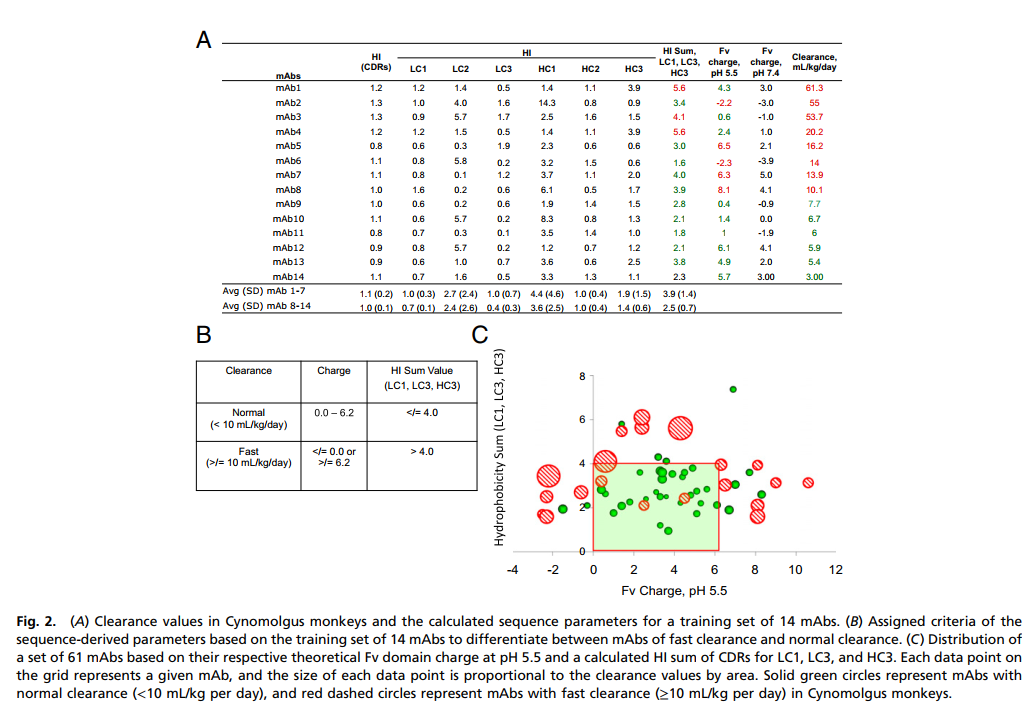
上述分析导致制定了标准,以将更快清除的mAb与正常清除的mAb区别开(图2B)。在训练集中,如果我们设置任意标准,则HI总和值> 4.0和/或Fv电荷值≤0或≥6.2的mAb可能表现出更快的清除率,而疏水性总和为≤4.0且Fv电荷值在0–6.2之间将显示正常清除率,然后与正常清除mAb(绿色)相比,更快地清除清除mAb(红色)。
我们将这些标准扩展到一组61 mAb,以测试其有效性。为了促进这种分析的可视化,我们使用Fv电荷和HI总和作为两个轴,将数据转换为图形格式(图2C)。每个mAb根据其各自的电荷绘制在图形上,并且HI总和值和每个数据点的大小与该mAb的清除率(按面积)成比例。每天所有≥10 mL / kg的Cyno清除率值用红色虚线圆圈表示,而其余具有正常清除率的mAb用绿色实心圆圈表示。实线方形框表示基于训练集的收费高和标准。显然,该标准适用于包括测试mAb在内的整套61 mAb。基于高HI总和或Fv电荷的极值,我们能够正确预测13个mAb中的10个(77%)mAb的更快Cyno清除率(包括训练组mAb的86%)和34个24中的正常Cyno清除率(70%)单克隆抗体(75%包括训练集的单克隆抗体)。表S2提供了此分析基础的说明。如果以不同的方式进行分析,也就是说,如果通过查看预测的结果检查了假阳性和假阴性,则也很明显,基于电荷和疏水性分配正常清除的可能性要高得多(只有3 mAb可以快速清除)与分配更快的清除率相比(预测为快速的10 mAb是正常清除)进行比较。总体而言,我们的分析实质上建立了使用电荷和疏水性的基本分子特性评估食蟹猴中mAb清除率的能力。
四、Trp氧化和Asp异构化
除了低粘度和正常清除率外,液体制剂由于易于与设备配合使用,因此对于在家中给药至关重要。 需要化学稳定性(防止氨基酸侧链修饰)以使液体制剂具有延长的货架期。 我们使用纯水对所有原子进行分子动力学(MD)模拟,以对Trp氧化和Asp异构化(可限制注射单抗水溶液的生存能力的常见降解途径)的相对liability 进行排名。 最近已经报道了一种基于同源性模型的方法来评估Asp异构化(17)。
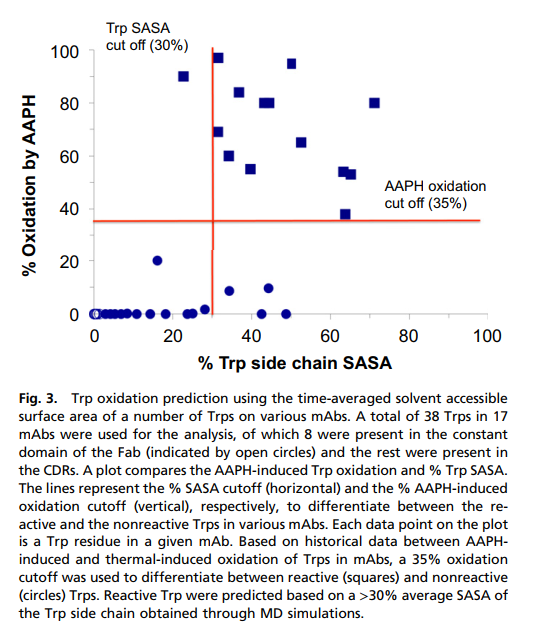
对于Trp氧化,我们检查了MD生成的时间平均溶剂可及表面积(SASA)与2,2'-偶氮双(2-ami基丙烷)二盐酸盐(AAPH)氧化Trp残基的程度之间的相关性(18)(图3)。我们评估了17种不同mAb中的38个Trp残基,其中大多数这些Trps都存在于CDR中,但在Fab结构域的恒定区中却存在8个Trps(图3中的空心圆所示)。检查%SASA和AAPH诱导的氧化之间的图清楚地表明对%SASA的二进制依赖性,其中低于某一%SASA的大多数Trp不经历氧化,而具有较高SASA%的大多数Trp显示出显着的氧化。历史上,我们观察到AAPH诱导的mAb中Trp的氧化与热诱导的Trp氧化相关。根据我们在AAPH氧化百分率和一组六个mAb的热诱导氧化之间可得到的历史数据,我们定义了一个标准,其中氧化> 35%的Trp被指定为氧化不稳定的Trp,氧化少于35%的Trp被指定为指定的不稳定Trp。基于此标准,我们针对反应性和非反应性位点检查了Trp残基的SASA百分比。该分析表明,Trp侧链的30%SASA的截止值(即80Å2)在很大程度上足以区分反应性和非反应性Trp位点。该选择的标准正确地鉴定了14个不稳定Trp残基中的13个(93%)和24个非不稳定Trp残基中的20个(83%)(图3和表S3)。因此,我们得出结论,Trp侧链的时间平均SASA足以区分不稳定和非不稳定的Trp残基,从而能够对氧化风险进行风险排名。应当指出,当前模型解决了有机自由基诱导的Trp氧化的问题,可能需要对其进行修改以将其效用扩展到其他氧化途径,例如光诱导或金属诱导的氧化。
对于Asp异构化,从MD轨迹产生与Asp残基有关的多个变量。与Asp异构化机制(19)一致,我们检查了以下特性:Asp侧链的时间平均SASA,n + 1个残基的肽主链N原子(-NH)[SASA(n + 1),N],与n +1个残基的-NH相关的肽主链H原子[SASA(n +1),H],Asp残基的残基内部信息(MI),φ-ψ分布的Shannon熵和均方根Cα原子的波动(RMSF)。选择了许多包含已知不稳定和稳定Asp残基的Fab用于MD计算。表S4中详细列出了MD模拟以及Asp站点的计算输出。我们专注于先前已证明的基序,以在影响保质期的时标上进行异构化(DG,DS,DT,DD,DA)(20、21),并排除了剩余的Asps。
将MD衍生的参数与在pH 5.5和40°C下的实验异构化降解速率进行比较。对于所研究的mAb,除仅针对单个mAb列出的非CDR Asp残基(框架残基)外,所有CDR Asp残基均包括在内。数据分析是双重的。首先,我们将不稳定残基(≥2.5%/ wk)与稳定残基(<2.5%/ wk)分开,并比较两组(不稳定和稳定)Asp残基中每种性质的平均值。 SASA,RMSF和SASA(n + 1,N)的三个特性在这两类Asp残基之间显示出显着差异(80%CI)(图4A)。接下来,我们评估了是否可以在实验速率和MD衍生的特性之间建立二元相关性;即我们能否简单地将比率> 2.5%/周的部位(即不稳定的残基)与那些比率<2.5%/周的部位(即稳定的残基)区分开来。为此,我们为大于2.5%/ wk的速率分配了1(不稳定)的值,为小于2.5%/ wk的速率(稳定)分配了0(稳定)的值(图4B)。然后,我们使用SASA,RMSF和SASA(n + 1,N)作为自变量,将二进制速率输出作为因变量进行逻辑回归。该回归结果输出的方程式显示为


该方程的输出四舍五入为一个有效数字,以得出结果为1(不稳定)或0(稳定),如图4B所示。
Logistic回归正确预测了六个不稳定位点中的五个和九个非反应位点中的全部九个。 本质上,通过逻辑模型生成的方程式使我们能够使用三个参数[SASA,RMSF和SASA(n + 1,N)]来预测,在测试实验条件,Asp残留物在低于2.5%/ wk时降解的敏感性。 我们使用类似于粘度分析的LOOCV方法测试了模型的有效性,其中我们预测了六个不稳定位点中的五个和九个非反应位点中的七个。 尽管正确预测的位点数量有所减少,但仍正确预测了15个位点中的12个位点(80%),因此该模型被认为令人满意。 最后,我们注意到,尽管这种建模方法是特定于当前的实验条件的,但是只要知道一组Asp残基的实验速率,基本方法就可以扩展到任何给定的实验条件。
五、讨论区
单克隆抗体是用于治疗包括癌症,自身免疫性疾病和感染在内的疾病的重要治疗剂。对于可制造性,易用性,患者便利性和较少频率的给药,使用具有正常清除率和预期的长血浆半衰期的mAb候选物来开发具有足够保质期的低粘度制剂至关重要。在这里,我们从简单的物理特性(例如疏水性,净电荷,电荷分布,柔韧性和溶剂可及性)显示出对这些特性的惊人的良好预测能力,这些特性很容易从氨基酸序列和单个mAb分子的MD模拟中获得。
疏水性和偶极电荷(dipolar charge)分布会增加溶液粘度,而蛋白质电荷会降低溶液粘度。先前的实验工作表明,mAb溶液的粘度是通过涉及疏水力和静电力的蛋白质-蛋白质相互作用来调节的(10,11)。通过使用计算机软件的研究结果与这些实验观察结果非常吻合。对于mAb的体内清除率,正常清除率与快速清除率以及基本mAb特性之间的相关性确实令人震惊。 mAb的快速清除被归因于mAb在体内的非特异性抗原非依赖性结合,因此在血浆中变得不可检测(14)。从根本上讲,这些非特异性相互作用(以及大多数生物蛋白质-蛋白质相互作用)是由相同的静电,疏水,范德华等物理力驱动的。我们证明了这些力/相互作用可以从基于简单序列的方法中提取分析并用于区分快速清除mAb和正常清除mAb。基于序列的分析可能是有效的,因为在本研究中使用了单个同种型的mAb,即IgG1。但是,总体方法可以扩展到其他同种型/亚型,并且可以包括基于结构的分析以扩展总体范围。对于特定于位点的特性(例如Trp氧化或Asp异构化),我们的工作与先前发布的关于哪些位点具有反应性或非反应性,从而影响shelf-life of the product的机制是一致的。对于Trp氧化,时间平均SASA可以区分反应性和非反应性位点。对于Asp异构化,机理更复杂。总而言之,我们在这里观察到的相关性将有助于更有效地选择候选mAb作为治疗剂。
六、方法
所有单克隆抗体均为在中国仓鼠卵巢(CHO)细胞中表达的IgG1同种型。注意,在本研究中使用的不同数据集中,mAb由数字表示,即mAb1和mAb2;但是,具有相同编号标识的给定mAb可能在不同数据集上不代表相同的实际原始mAb。
6.1 基于序列的参数
通过使用侧链的已知pKas(22)和Henderson-Hasselbalch方程将所有带电氨基酸的贡献相加,可以计算出在给定pH下给定序列的净电荷。 FvCSP是通过在给定pH值下获得VH域上的净电荷与VL域之间的乘积来计算的。正积是每个域上的净正电荷或净负电荷的结果。负积表示两个域之间缺乏电荷对称性,即一个域带有净负电荷而另一个域带有净正电荷。疏水性指数(HI)的计算公式为HI =-(∑ niEi / ∑ njEj),其中i代表疏水性氨基酸,即A,C,F,I,L,P,V,W和Y,以及j表示亲水性氨基酸,即D,E,G,H,K,M,N,Q,R,S和T; n是每个氨基酸的数目,E是每个氨基酸的艾森伯格标度值(23)。计算可以轻松转换为蛋白质的3D结构,其中参数n被S取代,S被定义为每个氨基酸的溶剂可及表面积(图S2)。
6.2 Viscosity
如先前所述使用Anton Paar Physica MCR 501锥板流变仪(Anton Paar)(24)进行粘度测量。
6.3 Clearance
本研究中使用的食蟹猴的清除率值是从先前发表的数据以及内部产生的其他数据中获得的(14)。
6.4 MD Simulations
MD起始结构
Fab的结构是从3D晶体结构(如果可用)或使用Modeler的局部adaption (25)生成的同源性模型获得的。 在添加离子(需要时)和显式溶剂分子之前,将Fab域用作MD的起始结构。
MD分析
所有SASA均使用GROMACS的g_sas计算得出(26); mutual information calculation在本地实施,类似于Lange和Grubmüller(27)。 GROMACS的g_rsmf,g_hbond和dssp分别用于计算均方根波动,氢键和二级结构状态。 Shannon entropy and mutual information 是使用先前公布的方法计算的(28)。 用于天冬氨酸异构化和分析的MD模拟遵循先前描述的方法(28),并使用TIP3P水进行溶剂化(29)。 色氨酸氧化的MD模拟以类似的方式进行,除了使用Amber 11(FF99SB固定电荷力场;使用Areaimol(30)计算SASA;使用100 ns轨迹),因为它们在可用的计算能力内提供了足够的数据。
6.5 AAPH诱导的Trp氧化。
通过将mAb溶液与AAPH分别以1 mg / mL和1 mM的最终浓度混合来进行AAPH诱导的氧化(18)。将溶液在40℃下孵育16小时。通过加入20mM Met淬灭反应,随后使用PD-10脱盐柱将缓冲液交换成pH 5.5的20mM缓冲液。然后使用胰蛋白酶消化液,然后通过LC-MS / MS对溶液进行分析,以进行位点特异性Trp氧化。
6.6 Asp降解速率的实验测定。
使用Centricon超滤管将mAb溶液进行缓冲液交换,最终配方为5 mg / mL的蛋白质在20 mM的pH 5.5缓冲溶液,240 mM蔗糖中。将样品置于40°C并在t = 0、14和28 d取出。
使用胰蛋白酶消化物,然后进行LC-MS / MS分析热应激样品。按照公开的方案(31)消化蛋白质样品,并在与Thermo Fisher LTQ Orbitrap质谱仪偶联的Agilent 1200 HPLC系统上进行肽图分析。使用Xcalibur软件(31)通过萃取离子色谱(EIC)确定每个位点的降解水平。
6.6 回归分析
主成分回归和逻辑回归分析使用XLSTAT(Addinsoft)进行。
参考资料
- Proc Natl Acad Sci U S A. 2014 Dec 30; 111(52): 18601–18606. In silico selection of therapeutic antibodies for development: Viscosity, clearance, and chemical stability. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4284567/
