【8】生物制药行业治疗性蛋白质候选药物可开发性评估的最佳实践(Best Practices in Developability Assessments of Therapeutic Protein Candidates in the Biopharmaceutical Industry)
一、前言
图8.1显示了发现和开发典型药物的各个阶段。在候选筛选,优化和先导分子选择过程中使用可开发性评估(Developability assessment ,DA)过程。可开发性评估通常涉及检查几个候选分子的属性,这些属性可以影响生产过程,配方,安全性和功效,然后选择一个达到目标预期的单先导分子。可开发性评估的主要重点是确定那些产品质量导致有利安全性和有效性的属性。这意味着除了满足所有期望的可开发性属性之外,所选择的候选者还应该增加生物活性评估。虽然生物活性总是胜过可开发性评估,但还需要通过表达和纯化来确保足够的生产力,以满足未来的商业需求并为加工和储存提供产品稳定性。通常检查的可显影性属性包括结构稳定性,化学稳定性,运输稳定性,光稳定性,粘度,体内稳定性,以及递送至工艺预期和满足目标产品概况的能力。通常,可开发性评估从多个候选者开始,最后确定具有所有期望属性或具有可通过进一步制定或过程开发或优化来补救的不利方面的候选者。通常,由于快速进入市场的压力,目标是在生物活性和可开发性属性之间实现适当的平衡。
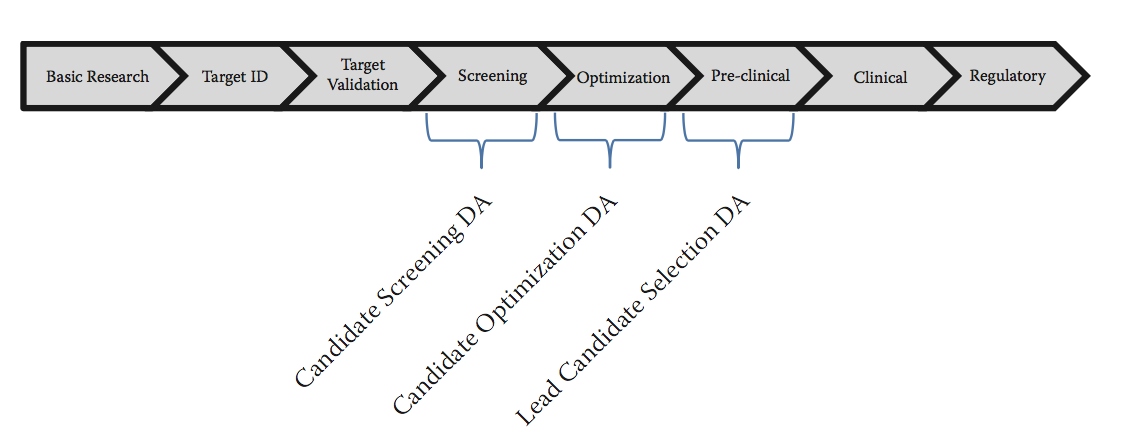
图8.1 参与典型治疗候选发展的阶段。 在候选筛选,优化和先导分子选择期间使用可开发性评估(DA)过程。
在整个可开发性评估过程中,解决了各种问题。例如,经常提出或考虑与生产率或产率,纯度,成本,化学和物理稳定性,适合于已建立的标准过程,对给药途径的适合性,血清半衰期,特异性,免疫原性,安全性和功效相关的问题。评估从使用计算工具检查一级序列开始,该计算工具有助于快速分析和分类大量序列。然而,虽然可以通过分析一级序列来预测某些属性,例如潜在的化学修饰位点,但我们仍然缺乏预测工艺开发和配制过程中出现的各种问题的能力,例如溶解度,粘度,或细胞生产力。同样,没有一个实验或研究可以迅速解决上述所有方面。由于这些原因,开始与多个候选物进行可开发性评估变得至关重要。快速消除或识别有问题的候选物的能力取决于具有完善的目标产品概况(target product profile,TPP)。例如,给药途径或给药可以确定是否需要粘度评估。如果需要配方,那么具有异常高粘度的那些分子可以被消除或靶向用于进一步的缓解策略,如果它们从生物学角度来看是主要候选物。虽然可开发性评估并不总能产生具有所有所需属性的最终候选者,但在可开发性评估期间收集的大量数据可能有助于指导流程开发或配方优化,并允许准确的资源和时间表计划,以及最坏的情况方案,触发候选物重新设计以交付给TPP。
在本章中,我们试图描述治疗性蛋白候选物(主要是抗体)的可开发性评估的最佳实践。最近在计算机序列分析和高通量工程方面取得的进展为我们提供了评估大量候选物的机会,也为实施从以前的评估中获得的知识提供了机会。序列分析方面的范围从分配残基编号方案到初级序列到预测特定的化学修饰位点。该工程主要由围绕蛋白质序列的过去经验衍生的知识及其与结构属性的关系驱动。它可以简单到将Asn残基突变为Gln以防止糖基化,将互补决定区(CDR)移植到不同的可变域框架上以避免使用稀有亚型。下一节将讨论生产率和成本这一重要问题。在治疗性蛋白质组中具有序列不同的候选物使我们能够在给定的一致表达和纯化过程中评估多个候选物。除了生产力之外,在筛选候选分子时必须考虑一系列其他属性,例如细胞密度和活力。纯化过程的主要目标是有效去除污染物,例如宿主细胞蛋白质和聚集体,对产物的最终产率影响最小。然而,对纯化程序的详细分析可以揭示与易于进行过程聚合或经历氨基酸修饰的某些候选分子相关的问题,例如Trp氧化或Asp脱酰胺。生物物理分析是可开发性评估的关键部分。通过生物物理分析建立的初始产品质量曲线与目标产品概况(TPP)一起确定随后的稳定性和制剂研究。因此,在工程阶段就将TPP置于早期阶段至关重要。
二、序列分析与工程:可开发性战略
蛋白质工程最初是由Kevin Ulmer在1983年创造的。简单地说,蛋白质工程是通过氨基酸的取代,添加或缺失来设计具有所需结构和功能的从头蛋白质。蛋白质工程背后的方向可能源于需要调节特定功能,无论是正面还是负面;改变其功能;改变蛋白质在其功能中的行为,例如通过改变蛋白质的半衰期或组织分布;或改变蛋白质在其环境中的行为,例如其热稳定性或化学改性倾向。这种工程水平的实施可以通过多种方式实现,但这些方法最广泛地描述为(1)合理设计(rational design)和(2)文库方法(library approaches.)。虽然这两种方法可以并且当然一起使用,但我们通过合理的设计将重点放在蛋白质工程领域。更具体地,我们利用抗体序列和结构的分析来发现特定的残基和区域,使得它们的修饰导致可制造的治疗活性分子。

图8.2 典型的工程和可开发性评估过程。 具有所需生物活性和生物物理特性,并且通过最小稳定性要求的工程化变体,有助于在先导广泛的可开发性评估过程中失败的情况下,快速替先导分子。 在整个过程中仅使用先导分子并在其中取得进展的另一种选择是有风险的,因为失败可能导致新的情况,并因此导致候选发展的显着延迟。
使用协调序列和结构的计算分析方法评估亲本抗体序列(图8.2)。利用一组具有所需结合或活性属性的抗体,首先使用AHo编号系统在结构上对序列进行比对,确保各个残基处于结构上对齐的外部一致位置。这不仅具有赋予各个残基结构意义的益处,而且还允许跨多个Fv序列的均一编号和比对,而不必使序列彼此对齐。 AHo系统还为CDR残基提供基于结构的间隙。从该比对中,进行基于序列的分级,其示出了整个组中的多样性,并且还允许在序列水平上评估密切相关的抗体(称为同胞),以帮助分析和潜在的工程。由于在小组中所有结合感兴趣的目标并且已经显示在筛选测定中具有活性,因此可以利用序列相似性和差异来指导优化以获得多种活性治疗剂,其将通过我们更严格,更广泛的,后阶段可开发性评估(图8.3)。
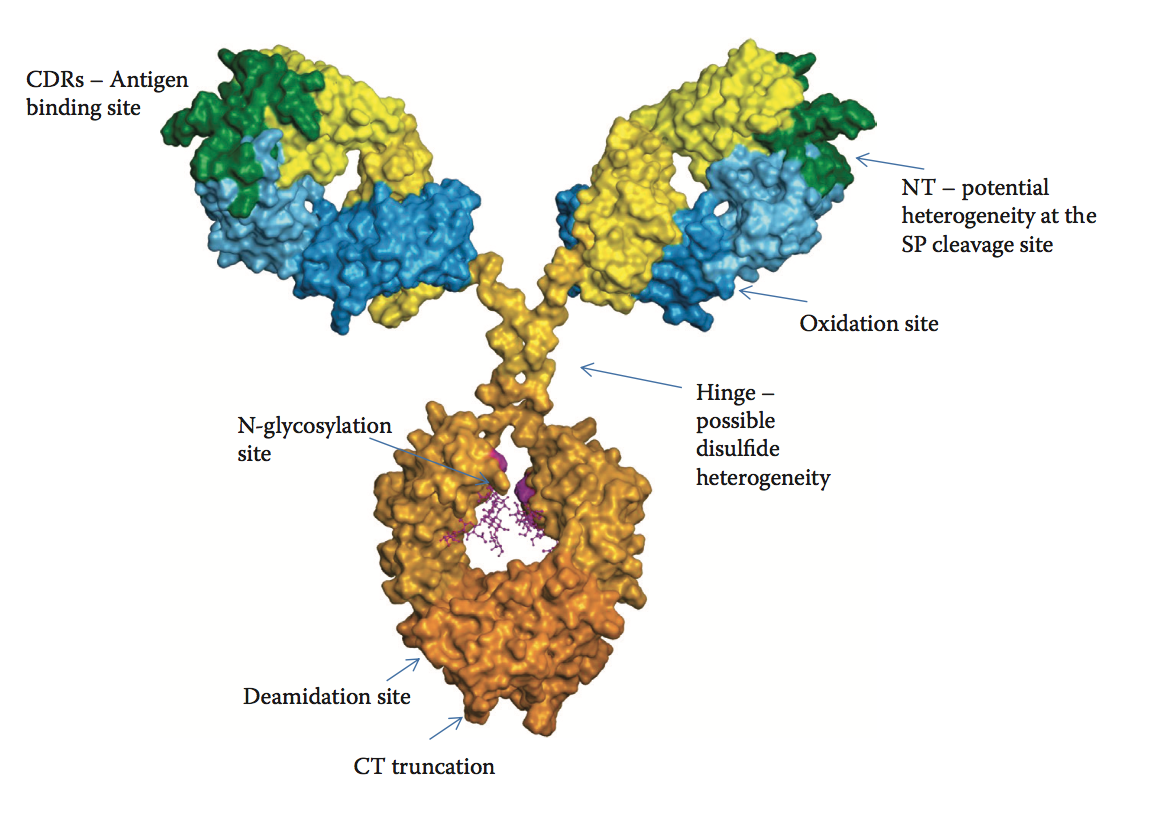
图8.3 抗体的模型结构。 使用Fab和Fc晶体结构来模拟完整的抗体结构。 N-末端位于CDR(抗原结合位点)附近。 突出了一些典型的热点区域和潜在的异质性。
然后使用分级来选择代表进化枝的单个抗体,并且使用来自Chemical Computing Group(Montreal,Quebec)的分子操作环境(MOE)内的抗体模型方法为每个构建Fv或Fab的结构模型。 框架的结构模板从单个实验结构中选择,以便最好地保持适当的Fv界面方向。 基于CDR长度,序列同一性和结构特征(例如分辨率)选择单个CDR模板。 在选择CDR模板时也要小心,其中残基在查询序列和模板之间不同,以努力做出合理的,基于结构的模板决策。 构建多个初始结构,每个结构具有多个侧链模型。
首先对各个抗体序列进行计算分析,以指导非标准半胱氨酸和N-连接糖基化位点的工程化。 如果抗体中存在这些热点中的任何一个,则将其修饰成多个变体以尝试去除该位点而不影响抗体的结合或活性。 如果特定位点的所有变体中的功能丧失,则不应采用亲本抗体。 对此的一个例外是如果显示非标准半胱氨酸形成稳定的二硫键,即使这样,也尝试并优选不含半胱氨酸的变体。 序列和结构都在这些热点的工程中起作用,导致在变体设计中考虑溶剂暴露,原子相互作用和sibling residue信息。
然后进行进一步的计算分析以识别脱酰胺位点,异构化位点和covariance violations。 虽然这些热点用于集中创建变体,但如果不能通过变异工程去除特定热点,导致维持活性,则个体热点可保留在最终抗体中。 抗体中的脱酰胺和异构化事件可导致它们发生的抗体中的功能丧失。 虽然现在不知道该位点是否会被修改,并且如果修改将影响功能,但没有热点的功能变体避免了在以后的可开发性评估中,对该位点进行特定压力测试的需要。
三、分子生产过程:上游开发评估
可开发性评估过程旨在从一开始就鉴定出具有适当生物活性的商业上可行的治疗性蛋白质候选物。 本节的重点是上游开发过程中的可开发性评估如何确保适当的生产力和属性,以满足未来的商业需求。
与仅基于生物活性的鉴定相比,良好的可开发性策略增加了选择具有总体更高生产力的候选分子的可能性。 有许多提高生产率的策略,例如流程开发期间的media优化。 然而,在可开发性评估的早期筛选具有序列多样性的一组候选分子,用于表达可以指导选择更高产量的候选分子(图8.4)。 在该筛选期间,使用相同的生产过程比较分子以直接观察分子对表达的影响。 适当的表达水平必须与多种其他因子相平衡,这可能意味着不能总是达到所需的上游滴度。 最后,通过捕获与每个候选者相关的所有表达数据,增强对候选序列对表达的影响的理解,可以指导未来的流程和成功率。
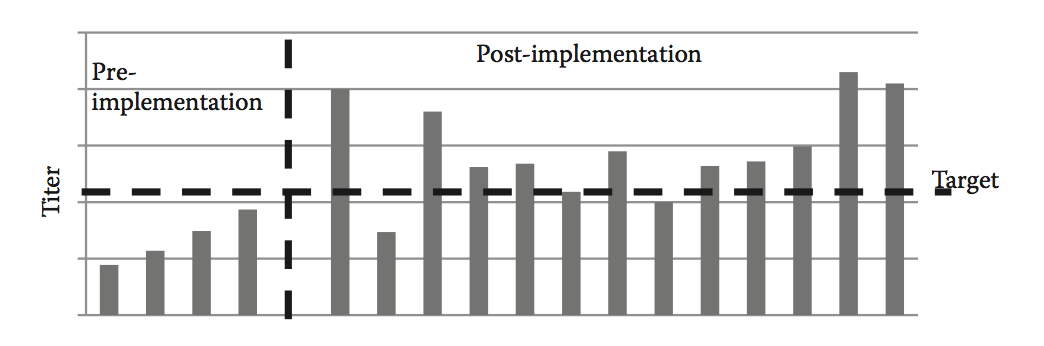
图8.4 使用相同的补料分批生产方法评估,上游可开发性评估的pre-implementation vs. post-implementation的滴度(titer)。 实施后,候选分子具有更大的潜力来满足滴度的目标要求。
除了生产力之外,在筛选潜在的候选先导分子时必须考虑一系列其他属性。这些包括在补料分批生产过程中候选细胞系的倍增时间,峰值细胞密度和终止培养生存力。使用代表性流程的倍增时间较长,生产率较低或增长不佳的候选物应被视为潜在问题。如果适应症需要高治疗剂量,则低滴度尤其令人担忧,因为它们会影响商品和制造成本(cost of goods and manufacturing,COGM)(图8.5)如何影响整体候选物选择。了解关键产品质量属性也很关键,例如聚集体和细胞培养过程中产生的其他高分子量(high-molecular-weight,HMW)物种的水平。某些候选分子可能具有HMW物种的倾向,并且在筛选过程中可以被淘汰或消除(图8.6)。 HMW趋势在亲本细胞系和克隆之间以及尺度上相关,因此它们是早期筛选潜在问题的良好预测因子(图8.7)。高水平的HMW物种可影响产量并且是潜在的免疫原性问题。此外,许多治疗性蛋白质含有一系列翻译后修饰,例如N-聚糖,氧化,脱酰胺和异构化,当在上游开发期间比较候选物时也必须考虑这些修饰。具有影响安全性或功效的翻译后修改的候选物,可能在随后的制造研究中提出控制挑战。
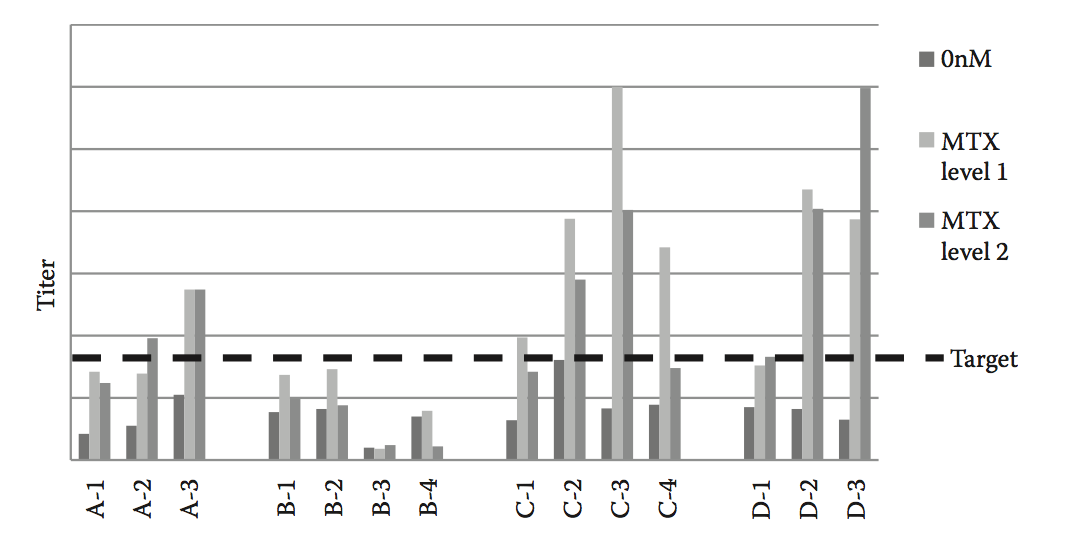
图8.5 使用补料分批生产测定评估来自针对四种不同候选分子(A-D)未扩增和扩增的多次转染的滴度。 在上游开发期间筛选表达候选物,可以帮助鉴定那些具有低表达的候选物。 基于该信息和为该项目生成的其他数据,选择候选C作为主要分子。
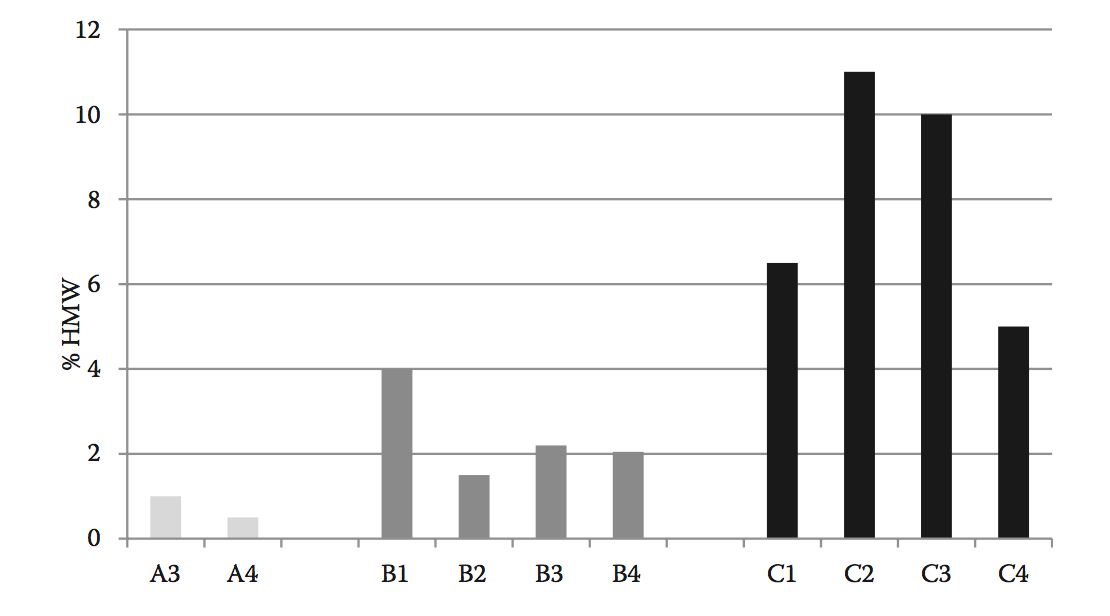
图8.6 来自三种不同候选分子(A-C)的多个扩增亲本细胞系的高分子量百分比,是从补料分批生产测定期间产生的蛋白A纯化的条件培养基中评估的。 在上游开发期间筛选HMW百分比可以识别具有高水平聚集的候选者。

图8.7 (a)从补料分批生产测定期间产生的蛋白A纯化的条件培养基评估亲本细胞系(B和C)的%高分子量和亲本细胞系产生的克隆。 HMW趋势对于亲代细胞系和随后在开发中衍生的克隆是相同的。 这种趋势也与不同尺度相关,如图8.7(b)中的相关图所示。 对于生物反应器,%HMW相关性具有0.805的高R2值,并且在y轴上显示与x轴上的小规模生产容器。
评估候选生产力时的一个挑战是在临床前开发的不同阶段使用多种宿主细胞系或过程条件,例如,使用人源细胞系进行早期瞬时表达筛选以及后来使用CHO或NS0稳定细胞系发育过程中的细胞宿主,过程和规模可能对候选分子的表达和产品质量产生影响(图8.8)。在可能的情况下,最好使用代表性的宿主和过程条件进行评估,或者很好地理解系统之间转换的属性(图8.9)。可开发性策略可以利用单一一致的标准过程来评估候选分子,并为上游商业过程中的后续性能提供早期输入。使用这些screens,可以观察不同候选者之间的表达和质量属性差异,并确定它们是否满足期望的目标值。
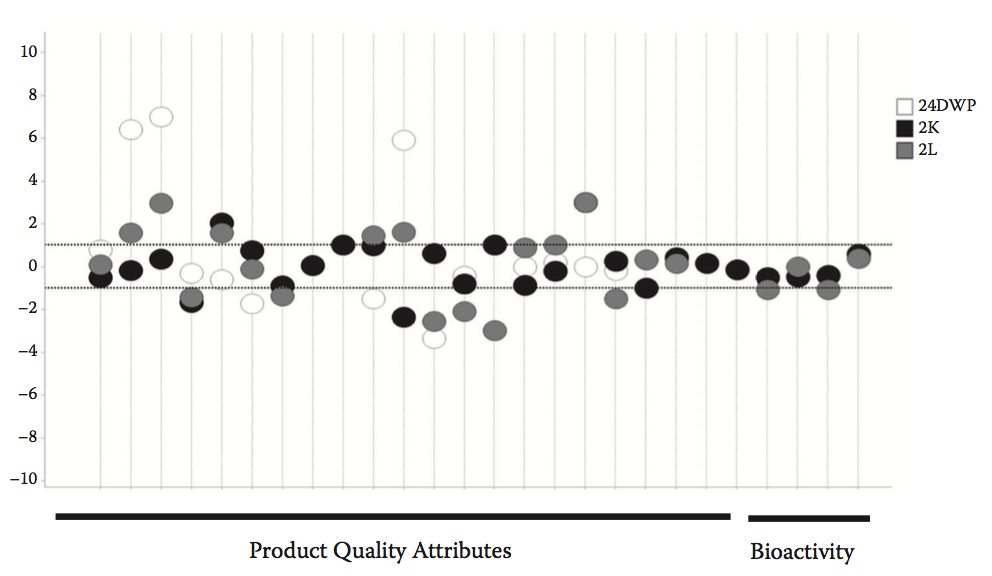
图8.8 流程规模可能会对PQ产生影响,如图所示。 小规模24深孔板(空心圆),2L生物反应器(灰色圆圈)和2000L商业规模反应堆(黑色圆圈)对于某些PQ参数(如糖基化)具有测定方差以外的差异,这可能受pH影响。 一个例子。 其他PQ参数如生物活性或%HMW受工艺规模的影响较小。
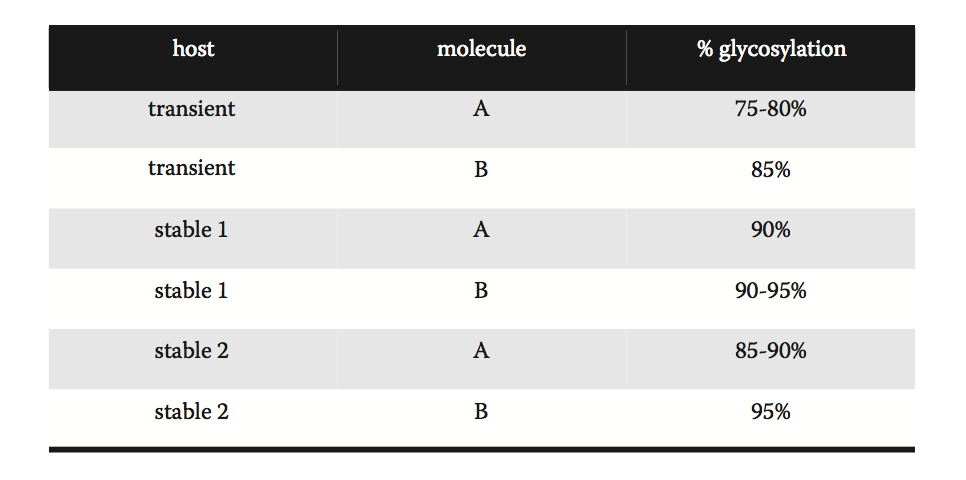
图8.9 宿主细胞系可能对产品质量产生影响。 在该项目实施例中,使用一种瞬时和两种稳定的宿主细胞系统来产生两种不同分子的细胞系。 得到的糖基化量根据宿主而不同。 这突出了使用最具代表性的系统来制定发展决策的重要性。
最后,在比较一组候选分子时,上游开发过程中的另一个重要考虑因素是信号肽的影响。 已经表明,即使在同一分子上,不同的信号肽也会对产物的异质性和分子的表达产生显着影响(图8.10c和d)。 使该问题最小化的一种方法是实施优选的信号肽,其干净地切割并且对不同分子的表达没有影响或影响最小。 诸如Signal 3P软件之类的工具可用于预测信号肽切割(图8.5a和b); 然而,这应该通过其他方法来确认,例如对代表性系统和过程产生的材料进行质谱分析。
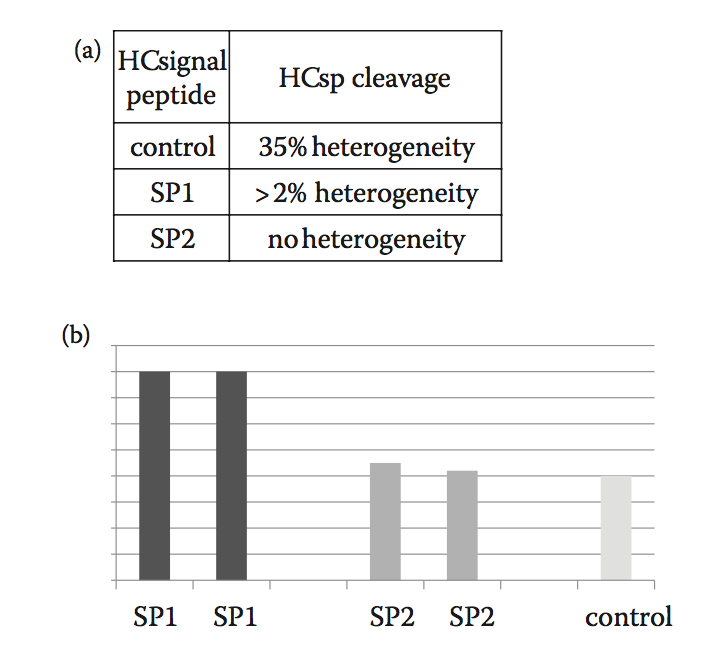
图8.10(a)和(b)。 Signal 3P软件用于预测对照和SP1信号肽的切割。 预测SP1信号肽比对照信号肽更好地切割。 在图8.10(a)中,该表显示了使用肽图谱观察到的重链信号肽切割的实际异质性。 两种交替信号肽SP1和2使用比对照信号肽更清洁地切割。 在图8.10(b)中表达后,与信号肽SP1和对照相比,使用信号肽SP1的细胞系也显示滴度增加。
四、分子生产过程:下游开发能力评估
候选治疗性蛋白质组的可开发性评估需要对产品属性进行排序比较,例如生物物理稳定性和功能读数,其依赖于稳健且自洽的过程来评估纯化和产品质量。 一组候选物的可开发性测定还依赖于纯化程序,该程序产生高质量的产物,以高产率分离同质的,单分散的非聚集蛋白质。 候选者可开发性的比较和排序不仅高度依赖于最终的纯化行为,而且高度依赖于整个纯化过程中的稳健分析评估。
初始候选物选择策略可包括蛋白质的基于核心序列的参数,例如类别(例如,含Fc),MW,pI和糖基化,此外,化学热点可能影响纯化和选择过程(表8.1)。 例如,蛋白质的等电点(pI)的知识可以直接影响纯化过程的建模。 选择经过热点修复的候选物也是可取的。 然而,应该仔细比较修改后的候选兄弟姐妹之间的纯化过程,以确定是否解决了有问题的行为。

产品质量属性可能受到各种影响,如表达滴度,以及通过纯化程序,如pH范围,树脂负载,树脂类型和缓冲条件(pH,盐)。 虽然表达效价作为候选物选择的起始标准是重要的,但表现出最高表达的那些也需要表现出良好的纯化效率,低聚集水平和高稳定性并证明功能。
在纯化的每个步骤中,分析过程的套件配对以从有希望的候选物中挑选候选物,其可以在稳健的纯化过程中存活。这些过程中的分析工具用于跟踪候选物的行为,指导未来的纯化程序开发,并对候选物进行排名(表8.2)。核心标准在线工具,如十二烷基硫酸钠(CE-SDS)的还原和非还原毛细管电泳,以及十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和分析性尺寸排阻高效液相色谱(SE) -HPLC)通常配对以监测污染物水平的总水平,并确定那些产生最高纯度和单分散性的色谱步骤或级分。在色谱分析中,SE-HPLC还可以与在线多角度光散射配对,进一步细化聚集体和单分散物质的边界,从而有助于蛋白质库分析。利用CE-SDS,成像等电聚焦(CE-IEF),例如,如果重链和轻链,剪辑和氨基酸修饰的配对在可接受的参数范围内,那么在纯化过程早期的反相(RP)方法也可以突出显示。可以在过程中使用质谱分析技术来验证目标治疗剂的质量(纯度,剪辑,氨基酸修饰)或帮助定量宿主细胞蛋白的负担

纯化的目的是有效地从产品中去除污染物,宿主细胞蛋白(HCP),聚集体(aggregates,HMW)和修剪形式(LMW),对最终产量的影响最小。确定可开发性标准化一系列类似候选类别的纯化程序和分析提供了进行头对头比较的机会。例如,蛋白A将标准地用于抗体捕获,然后与离子交换或疏水相互作用色谱(HIC)步骤配对,用于宿主细胞蛋白和聚集物去除(图8.11)。对纯化和加工步骤结果的详细分析可以揭示与某些候选分子相关的问题,例如在低pH病毒灭活保持期间易于进行过程聚集或已经经历氨基酸修饰的那些,例如Trp氧化或生产过程中的Asp脱酰胺。已经观察到一些纯化工艺步骤影响聚集水平,包括蛋白A洗脱后的低pH保持,尽管减少病毒负担的方便步骤可能带来聚集的风险。还有报道称,使用某些强阳离子交换树脂(CEX)可能导致某些抗体类别的额外聚集。跟踪这些过程中的分析数据还有助于改变纯化过程以改善这些类型的问题。

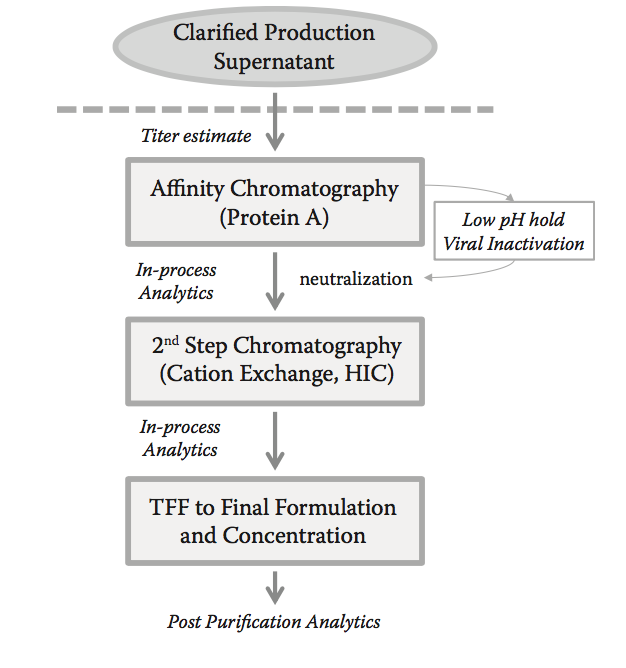
图8.11 标准抗体纯化途径。 在此,过程中纯化分析逐步查询滴度,纯化池,工艺步骤产量,聚集体和细胞宿主蛋白(CHOP)。 通常,将澄清的上清液(例如,哺乳动物细胞表达)加载到已经确定富集靶蛋白并除去大量宿主蛋白的亲和步骤。 这里的例子是利用高容量蛋白A来分离抗体。 低pH值保持是实现病毒负荷减少的典型过程中步骤,并且监测该步骤的总体水平的冲击产物。 色谱的第二步,例如阳离子交换,试图进一步降低聚集体和细胞宿主蛋白水平。 使用切向流过滤(TFF)策略的最终缓冲液交换和浓缩是实施分析策略以例如监测聚集水平的另一点。
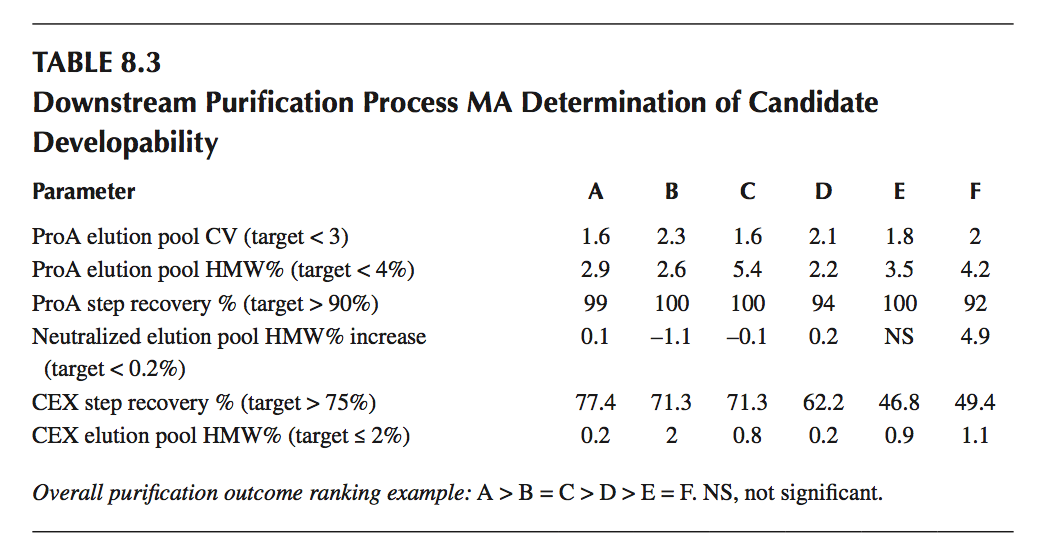
通过结合基于序列的参数的产量的纯化结果的知识,和分析评估来确定分子的可开发性。表8.3演示了候选集的示例制造评估读数。这里候选物按纯化质量测定(产量与聚集)排序:A> B = C> D> E = F.蛋白质A和CEX阳离子交换步骤后的产量评估未发现候选者之间的质量差异。如该实施例所示,CEX洗脱曲线和合并标准要求低聚集水平(SE-HPLC),导致候选物A(低聚集体)的回收率更高且可发育性水平高于候选物F(高聚集物)。纯化评估的输出是在类似处理条件下的候选性能的比较,其导致所有候选者的给定目标产品质量的最终产量。产量的差异,过程中的候选性能以及产物纯度/质量都被考虑在一起以对候选分子进行排序。
五、溶解稳定性:可开发性方面
质量设计(Quality by design,QbD)描述了设计和开发配方和制造工艺背后的原则,以确保预先确定的产品质量目标。 这些预定目标可以在TPP中进行总结。 了解TPP与配方相关的方面构成了创建配方设计空间的基础,候选者可以进行筛选,其中适合设计空间的表现良好的分子比不属于设计空间的分子具有更大的可开发性潜力。 TPP输入可以来自治疗开发的许多方面,其中大多数涉及安全性和功效(例如产品质量和治疗剂量),但许多可以解决商业方面,例如患者使用,储存和期望的保质期。当定义TPP的所有方面时,可以创建期望的配方设计空间( design space )。
在实践中,最好避免那些在商业化过程中可能带来重大挑战的候选者。 实际上,就配方设计空间而言( formulation design space),生物学可能需要非理想或表现不佳的分子。 及早识别潜在的问题,通常可以导致进一步的工程设计,可以减轻或限制这些负债,或者至少提供风险平衡的视角,将非理想的候选者推向临床开发,并允许调整时间表或资源以促进 临床开发。
六、分子溶液性质:配方开发性评估
为每个候选者建立初始产品质量概况至关重要,因为它用于确定候选者的身份,翻译后修饰的水平和类型,以及材料在尺寸变异方面的纯度(表8.4)。这些方面中的每一个都可以对后续研究产生影响,并且本身可以快速确定候选者在评估过程中前进的能力。应该对不正确的候选者,具有大量修饰的氨基酸残基的候选者和高度聚集的候选者进行评估,因为每种候选者都可能对进一步研究的有效性产生不利影响。候选产品质量概况至少应与TPP中规定的期望保持一致。如果候选着未达到TPP中规定的既定最低要求,则可考虑将候选者从评估中删除。最后,产品质量数据为后续研究提供了基线(时间= 0)。

通常可以通过对完整分子进行质谱(mass spectrometry,MS)分析,并将预测分子量与观察到的分子量进行比较来确定候选物的身份。另外的分析可以包括去糖基化或还原和烷基化分子的完整MS分析,以评估没有N-连接聚糖(mAb)的候选物,或分析通过二硫键共价连接的单个肽链,如IgG的情况。这可以通过最小化聚糖异质性,或通过鉴定单个重链和轻链来帮助进一步确认候选身份。不能确定候选者的特定身份(由预测的氨基酸序列确定)应导致从评估中消除候选者。肽图可用于通过使用一种或多种酶进一步确认同一性以提供100%的序列覆盖。如上所述,初始(t = 0)肽图用于询问候选物在氨基酸修饰方面的纯度,并建立任何序列异质性,例如来自信号肽或C-末端赖氨酸变体的N-末端延伸。可能无法仅从序列中直接预测。最后,关于大小变体评估蛋白质的生物物理状态,以确定每种候选物的纯度。测定通常包括尺寸排阻色谱(SEC)以评估高和低分子量物质(HMWS和LMWS),以及用SDS(rCE-SDS)减少毛细管电泳以评估共价聚集体和修剪物种。这些测定的结果将在后续研究中用作t = 0数据集。基于聚集的性质和程度以及期望的TPP,可以对重度聚集或剪切的候选物进行进一步分析,额外纯化或消除。
在确定候选者的正确身份之后,最重要的是候选物的溶解度。 未能达到目标产品概况浓度可能会限制候选物成为可行的治疗候选物的能力。 为了排列和识别有问题的候选物,溶解度可以通过目视观察(浑浊,沉淀,胶凝等)以及过滤后的紫外吸收光谱(A280)轻松确定,其中与未过滤样品的比较可能表明 由于缺乏溶解性而导致材料损失。 除溶解度评估外,还可以在不同的应力下评估给定浓度下的稳定性,然后与适当的对照进行比较(表8.5)。
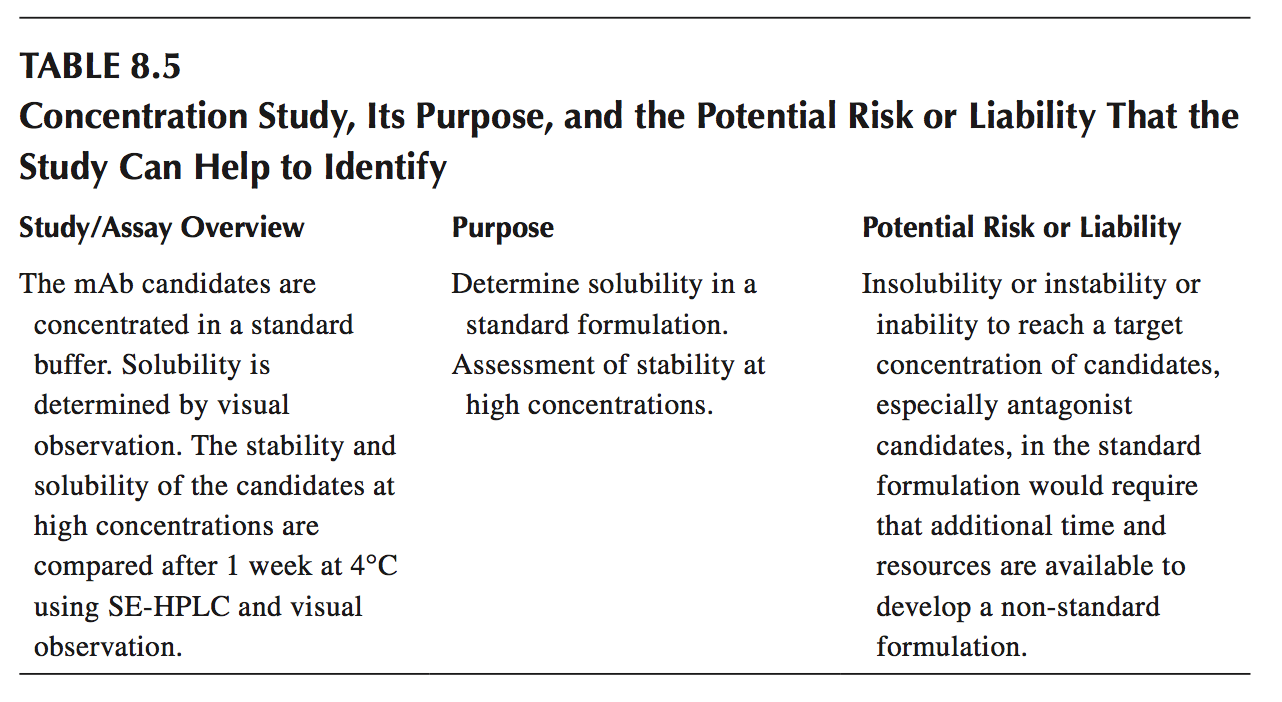
候选者在目标产品概况浓度下的稳定性,提供了在长期储存和运输压力期间其如何表现的透视图。此外,如果候选者进入临床开发阶段,在给定的配方条件下或在给定的压力下评估候选物的物理和化学稳定性,也可用于识别可能需要在配方开发期间更长的开发时间或资源负担的计划风险。高温(例如,37°C或25°C)以及目标临床储存温度(液体治疗蛋白通常为4°C)下的稳定性可用于确定生物化学和生物物理负担,例如聚集,颗粒化目标产品型材配方条件下的剪切,电荷分布变化和氧化(表8.6)。所采用的技术通常包括SEC,离子交换色谱(IEX),动态光散射(DLS),还原和未还原的CE-SDS和肽作图。额外的压力研究可用于针对特定的生化负债(如果存在),例如在生产或填充操作过程中可能遇到的氨基酸对光照的氧化敏感性。还可以筛选候选物以确定它们抵抗典型的能力加工,输送或运输应力,例如冷冻和解冻,对与皮下注射相关的pH变化的敏感性,以及对搅动的抗性。

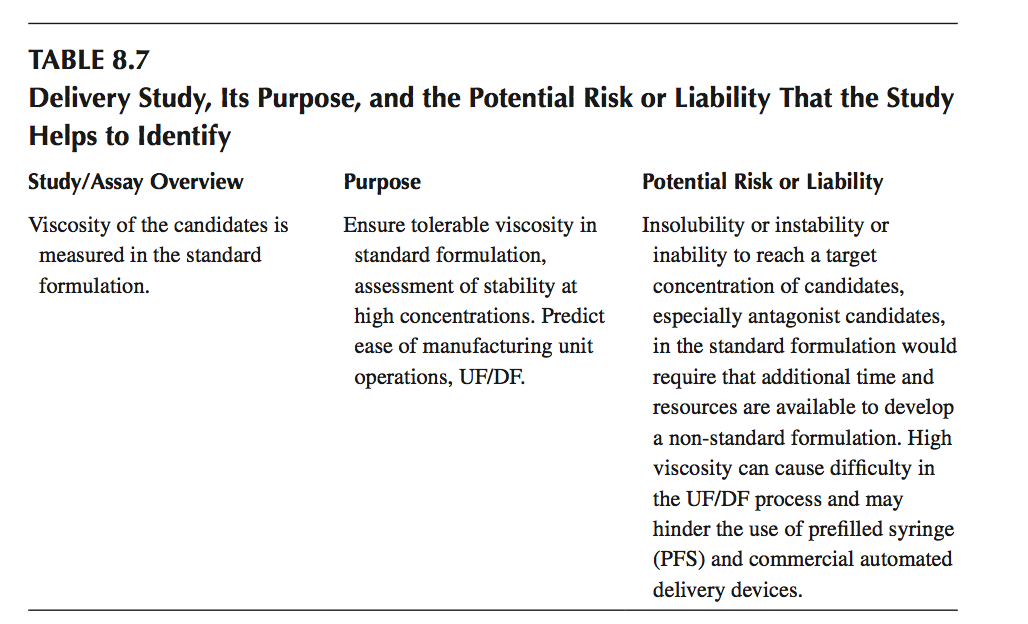
目标产品分布浓度下候选物的粘度可用于识别不易满足过程或输送装置限制的分子,而不会在开发过程中产生额外的时间或资源支出(表8.7)。 可以使用锥板流变仪(cone and plate rheometers)以及DLS进行粘度测定。
七、结论
可开发性评估的主要重点是确保可制造性,安全性和有效性(manufacturability, safety and efficacy)。 在可开发性评估期间检查各种属性。 根据过程中检查的属性消除候选物取决于手头有TPP。 序列分析可用于筛选大量候选物,并鉴定具有序列多样性和较少化学热点的候选物,用于进一步的工程和可开发性评估。 虽然我们目前缺乏使用计算工具预测大多数问题的能力,但未来可能会看到工具开发的重大进步。 在可开发性评估期间收集的大量实验数据将提供学习和理解,帮助预先设计候选物,提高质量和安全性。
参考资料
- 《Developability of Biotherapeutics》
