【6.1】p53替代癌症疗法
涉及各种递送系统的肿瘤抑制基因(TSG,Tumor suppressor gene)替代疗法正在成为一种有前途的抗肿瘤策略,因为恶性肿瘤是通过TSGs的基因改变而发展而来的。抑制肿瘤最有效的治疗性TSG是多功能转录因子p53基因,该基因可调节多种细胞现象,例如细胞周期停滞,衰老,凋亡和自噬。由于在人类癌症中,p53基因经常因异常的基因调控而失活,因此,p53替代疗法被广泛且频繁地用作有效的抗肿瘤策略,以在p53失活的肿瘤中恢复野生型p53的功能。本章重点介绍四种类型的p53转移系统:
- 阳离子脂质体-DNA质粒复合物,
- 复制缺陷型腺病毒载体,
- 复制型腺病毒载体
- 蛋白质转导系统。
此外,我们讨论了对p53介导的细胞死亡信号传导途径的分子基础的了解以及在p53替代疗法中增强肿瘤细胞死亡和诱导肿瘤组织内旁观者效应的治疗方法的最新进展。 对p53介导的肿瘤抑制网络系统的分子机制的探索,以及增强p53介导的细胞死亡信号转导途径的有效策略的发展,将导致p53灭活的癌症患者的临床预后得到改善。
一、引言
肿瘤抑制基因(TSG)替代疗法正在成为一种有前途的抗肿瘤疗法,可通过引入治疗性TSG来诱导程序性细胞死亡(Roth和Cristiano) 1997年)。在用于诱导肿瘤抑制的治疗性TSG中,最有效的TSG是p53基因,其作为多功能转录因子,可调节多种细胞现象,例如细胞周期停滞,衰老,凋亡和自噬(Vousden和Prives2009年)。IARC TP53数据库( http://www-p53.iarc.fr/ )(Olivier等。2002年)表明各种类型的恶性肿瘤在p53基因中具有体细胞突变(Olivier et al。 2010年; 奥格尼亚诺维奇(Ognjanovic)等。2012年)。在人类癌症中,异常的基因调控经常使p53基因失活,这表明p53基因在肿瘤抑制网络中起着至关重要的作用。因此,恢复野生型p53功能将是一种有前景的抗肿瘤策略,可以强烈抑制p53灭活的肿瘤的生长。
p53替代疗法被广泛且频繁地用作有效的抗肿瘤策略,以诱导p53基因的表达以及随后许多类型的具有p53灭活状态的恶性肿瘤的细胞死亡(Roth等。 1999年; 芳和罗斯2003年)。为了诱导外源性p53基因或p53蛋白的异位表达,有四种类型的p53转移系统:阳离子脂质体-DNA质粒复合物,复制缺陷型腺病毒载体,复制型腺病毒载体和蛋白质转导方法。外源性p53表达的激活有效地诱导了p53灭活的肿瘤细胞中p53介导的细胞死亡信号通路。相反,通过用诸如Nutlin-3(Selivanova2014年)或PRIMA-1(Bykov和Wiman 2014年)是另一种恢复野生型p53功能的策略。Nutlin-3通过抑制MDM2-p53相互作用来诱导过表达p53-抑制性小鼠doubleminute 2(MDM2)的肿瘤细胞中的p53稳定化(Vassilev等。2004年)。PRIMA-1通过恢复具有p53基因突变的人类癌细胞中的DNA结合活性和突变p53蛋白的功能构象来诱导凋亡(Bykov等。2002年)。然而,由于Nutlin-3和PRIMA-1的治疗潜力分别限于具有MDM2过表达和特定p53基因突变(R175H和R273H)的肿瘤,因此用于诱导外源性p53表达的p53转移系统将提供有用的抗肿瘤策略,可能是在p53替代疗法中使用更为广泛和频繁。
本章重点介绍通过使用四种类型的p53转移系统之一来诱导外源p53基因或p53蛋白过表达的p53替代疗法的最新进展:基于脂质体的p53 DNA质粒递送,基于复制缺陷的腺病毒的p53基因传递,具有复制能力的基于腺病毒的p53基因传递和基于膜透性肽的p53蛋白传递。此外,我们将讨论我们对腺病毒载体诱导的p53介导的细胞死亡信号通路的分子基础以及增强针对肿瘤细胞的p53介导的细胞死亡的有效联合策略的分子机制的理解的最新进展。
二、p53介导的细胞存活和细胞死亡信号通路
通常,有几种类型的p53介导的细胞死亡信号转导途径,包括衰老,凋亡和自噬(图 1)。当具有完整p53功能的肿瘤细胞处于遗传毒性压力下时,p53被激活以转录诱导多种p53下游靶基因,例如p21 WAF1(p21)(el-Deiry等。1993年),BAX(宫下和里德 1995年)或损害调节自噬调制器(DRAM)(Crighton等 2006年)。在轻度的遗传毒性压力下,p53主要上调p21表达以诱导细胞周期停滞,从而修复DNA损伤并有助于细胞存活。然而,通过p21激活持续的细胞周期停滞导致衰老相关细胞死亡的诱导,而不是细胞存活。相比之下,严重的遗传毒性应激会诱导p53的更高积累,从而激活BAX和DRAM相关的信号传导途径,分别导致凋亡和自噬,并导致细胞死亡。但是,当p53下游靶基因MDM2时(Barak等。1993年)是通过遍在蛋白-蛋白酶体途径对p53的负调节剂,在p53激活后被上调,MDM2激活作为p53负反馈回路抑制了p53介导的信号通路。因此,p53介导的细胞存活和细胞死亡途径受到多种p53下游靶基因的严格调控。
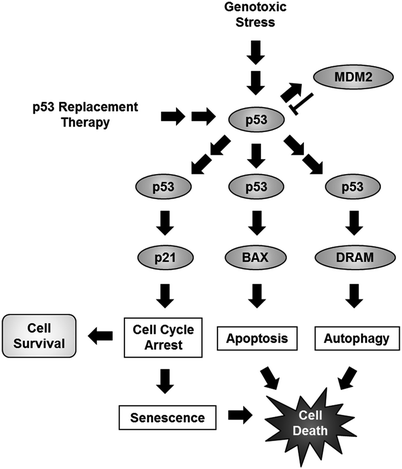
图1 基因毒性应激或p53替代疗法诱导的细胞存活和细胞死亡途径的方案。基因毒性应激通过分别激活p53靶基因p21,BAX或DRAM诱导细胞周期停滞,凋亡或自噬。轻度的遗传毒性应激会诱导少量p53的积累,从而导致p21依赖性细胞周期停滞和细胞存活。但是,严重的遗传毒性应激会诱导p53大量积累,从而导致三种不同的细胞死亡途径被激活:衰老,凋亡和自噬。此外,p53诱导的MDM2激活通过遍在蛋白介导的p53降解而充当p53负反馈回路。相反,p53替代疗法通过外源性p53基因或p53蛋白的异位表达诱导p53介导的细胞死亡信号通路。
三、 p53替代疗法
为了在各种经p53灭活的肿瘤细胞中恢复野生型p53功能,在临床前和临床环境中,通过使用几种转移方法中的一种来过度表达外源性p53基因或p53蛋白是一种有效的策略(图 1)。基于脂质体的p53 DNA质粒传递或基于病毒的p53基因传递在转录上激活外源p53基因的异位表达,而基于膜渗透性肽的p53蛋白传递直接诱导外源p53蛋白的异位表达。在以下各节中,我们将展示p53替代疗法在临床前和临床环境中的治疗潜力,该疗法涉及脂质体-DNA质粒复合物,复制缺陷型病毒载体,具有复制能力的病毒载体或蛋白质转导方法。
3.1 带有DNA质粒的阳离子脂质体复合物 Cationic Liposome Complex with a DNA Plasmid
阳离子脂质体是有用的递送系统,可用于在体外实验中将编码异位p53的DNA质粒载体转染到人类癌细胞中(Xu等。 1997年; 邹等。1998年; Ramesh等。2001; 中濑等。2005年)。为了提高转染效率和质粒载体的肿瘤特异性递送,最近已开发出抗体偶联的免疫脂质体用于癌症治疗(Xu et al。2001, 2002年; 冯等。2009年, 2010年)。然而,使用任何一种基于脂质体的方法的转染效率仍然很低,不足以诱导细胞死亡,特别是在体内肿瘤组织中。因此,需要改进基于脂质体的递送系统以有效地诱导肿瘤组织内p53介导的细胞死亡。
3.2 复制缺陷型腺病毒载体 Replication-deficient Adenovirus Vector
与用质粒DNA载体诱导外源p53的低转染效率相比,复制缺陷型腺病毒Ad-p53载体已显示出可有效诱导外源p53基因的表达,并在临床前的体内和体外发挥后续的抗肿瘤作用实验(图 2)(Roth等。1999年; 芳和罗斯2003年)。Ad-p53介导的肿瘤抑制系统包括三种细胞死亡途径:衰老,凋亡和自噬(Vousden和Prives2009年)。这些细胞死亡途径是通过诱导几个p53下游靶基因(例如p21)来确定的(el-Deiry等。1993年),BAX(宫下和里德 1995年)或DRAM

图2 Ad-p53,OBP-301和OBP-702载体的DNA结构。Ad-p53载体是表达p53的复制缺陷型腺病毒。将在巨细胞病毒启动子(CMV-p)的调控下的p53基因表达盒插入E1区。E3区域被删除。OBP-301载体是具有端粒酶特异性复制能力的溶瘤腺病毒。在hTERT的基因启动子(的hTERT-p)的元件驱动器两种腺病毒的表达E1A和E1B链接到一个内部核糖体进入位点(IRES)的基因。OBP-702载体是表达p53的条件复制腺病毒。在OBP-702中,将由Egr1启动子(Egr1-p)控制的p53基因盒插入OBP-301的E3区

图3 一种由Ad-p53介导的细胞死亡途径诱导和增强基于Ad-p53的p53替代疗法的方案。当与表达E1A的具有复制能力的OBP-301结合使用时,Ad-p53载体分别诱导BAX和DRAM介导的凋亡和自噬,从而导致细胞死亡,而不是p21依赖性细胞周期停滞和细胞存活。复制缺陷型腺病毒载体(Ad-E2F1,Ad-ARF,Ad-FHIT),Nutlin-3或p21抑制性siRNA / miRNA
为了进一步促进Ad-p53介导的细胞死亡途径,存在一些组合策略用于增强Ad-p53感染的肿瘤细胞中的病毒复制,p53表达和p53介导的细胞死亡(图 3)。第一种策略是在联合疗法中使用表达E1A的溶瘤腺病毒,因为Ad-p53是E1A缺失的复制缺陷型腺病毒载体。例如,我们先前产生了端粒酶特异性复制型溶瘤腺病毒OBP-301(端粒细胞溶素),它以端粒酶依赖性方式诱导肿瘤选择性细胞裂解(图 2)(Kawashima et al。2004年; 藤原等。2007年; 桥本等。2008年)。与联合用Ad-p53单药治疗相比,OBP-301在联合治疗中增强了Ad-p53诱导的p53表达,从而产生更强的抗肿瘤作用并增加了凋亡细胞死亡(Sakai等。2010年)。OBP-301诱导的腺病毒E1A积累被用于Ad-p53的复制,从而增强了Ad-p53介导的p53表达。第二种策略是抑制MDM2表达,因为MDM2的p53下游激活通过泛素介导的p53降解抑制了p53功能。用小分子化合物Nutlin-3进行处理(Graat et al。2007年),或感染了肿瘤抑制因子脆性组氨酸三联体(FHIT)基因(Nishizaki等,2007年)。2001)通过抑制人类癌细胞中的MDM2来增强Ad-p53介导的p53表达和凋亡细胞死亡。此外,Ad-ARF感染会导致ARF基因过表达(Tango等人。2002年)或Ad-E2F1(Itoshima等。 2000)通过ARF介导的MDM2抑制增强p53的表达和Ad-p53诱导的抗肿瘤作用。第三种策略是抑制p21表达,因为p53下游p21激活可诱导细胞周期停滞和随后的细胞存活。通过基因缺失抑制p21表达(Gorospe等。1997年)或外源性p21靶向的siRNA(Idogawa等, 2009年)增强Ad-p53诱导的细胞凋亡。此外,靶向p21的miRNA miR - 93和miR - 106b可以增强Ad-p53介导的细胞凋亡和自噬(Hasei等人。2013年),因为p21可以抑制细胞凋亡(Gorospe et al。 1997年)和自噬(Fujiwara等, 2008年)。因此,增强Ad-p53介导的细胞死亡途径的这三种策略可用于提高基于Ad-p53的p53基因替代疗法的治疗潜力。
3.3 具有复制能力的腺病毒载体 具有复制能力的腺病毒载体
尽管在许多临床研究中,复制缺陷型Ad-p53载体在患有各种类型癌症的患者中被证明是安全,可行且耐受性良好的(Tazawa等。 2013年),由于用Ad-p53进行治疗,可能很难诱导所有肿瘤细胞中高水平的外源性p53表达,因为它是复制缺陷型病毒。因此,经由这种复制缺陷型Ad-p53载体的p53基因转移的低转导率是改善晚期癌症患者的临床结果的主要问题。为了提高p53基因替代疗法的转导效率,正在开发具有肿瘤特异性,具有复制能力的溶瘤腺病毒作为抗癌基因疗法的新型载体。例如,癌症相关基因的启动子被用于以肿瘤依赖性方式调节病毒复制。我们之前开发了一种端粒酶特异性复制型溶瘤腺病毒OBP-301,与内部核糖体进入位点连接的E1A和E1B(图 2)(Kawashima等。2004年)。OBP-301可以端粒酶依赖性方式诱导肿瘤特异性细胞裂解(Kawashima et al。2004年; 藤原等。2007年; 桥本等。2008年)。在美国,晚期实体瘤患者对OBP-301的I期临床研究具有良好的耐受性(Nemunaitis等。2010年)。当Ad-p53与OBP-301结合使用时,p-53的表达和由Ad-p53诱导的抗肿瘤作用得到增强(Sakai等。2010年)(图 3)。基于这些证据,我们生成了一个武装的OBP-301变体(OBP-702),该变体在Egr1启动子的控制下表达野生型p53基因(图 2)。在上皮和间质类型的恶性肿瘤细胞中,OBP-702比Ad-p53或OBP-301更有效地抑制了对OBP-301敏感和对OBP-301耐药的肿瘤细胞的活力(Yamasaki等。2012年; Hasei等。2013年)。Ad-p53和OBP-301分别主要诱导凋亡和自噬细胞死亡,而OBP-702通过外源性p53在肿瘤细胞中的过度表达引起凋亡和自噬细胞死亡。这些结果表明,OBP-702通过高p53过表达诱导凋亡细胞和自噬细胞死亡。
关于OBP-702在诱导细胞死亡方面优于Ad-p53的分子机制,我们最近发现p53介导的细胞死亡信号转导途径的E1A依赖性增强与有效的OBP-702诱导的抗肿瘤作用有关(图 4)。当肿瘤细胞被相似剂量的Ad-p53或OBP-702感染时,OBP-702诱导的p53表达水平要高于Ad-p53(Yamasaki等人。2012年; Hasei等。2013年)。较高的p53表达是由于OBP-702的病毒复制所致,因为Ad-p53是复制缺陷型病毒。然而,尽管它们的p53表达较高,但在受OBP-702感染的肿瘤细胞中p53下游靶标p21和MDM2的表达水平却比受Ad-p53感染的肿瘤细胞低(Yamasaki等。2012年)。p53和p53下游靶标p21和MDM2的表达水平之间的这种差异是由于腺病毒E1A积累引起的。E1A积累诱导E2F1诱导的miR - 93和miR - 106b上调,从而抑制p21表达并增强p53介导的细胞凋亡和自噬作用(Hasei等。2013年)。相反,E1A介导的E2F1上调导致通过ARF激活抑制MDM2表达。这些证据表明,OBP-702通过依赖E1A增强p53介导的细胞死亡信号通路,比Ad-p53更有效地诱导抗肿瘤作用。

图4 OBP-702介导的细胞死亡途径诱导方案。OBP-702载体分别诱导BAX和DRAM介导的细胞凋亡和自噬,导致细胞死亡。这些作用取决于通过E2F1诱导的miR-93和miR-106b激活而由E1A介导的p21表达的抑制。此外,E1A介导的MDM2抑制,可能是通过E2F1诱导的ARF激活,也可增强p53介导的细胞死亡
3.4 蛋白质转导疗法
使用腺病毒载体的P53替代疗法可以在各种类型的人类癌症中更强烈地诱导外源性p53基因的异位表达,这是基于质粒的递送系统所诱导的。由于腺病毒可以通过与病毒颗粒以及柯萨奇和腺病毒受体(CAR)的直接相互作用进入人类癌细胞,因此表达CAR的肿瘤细胞是基于腺病毒的p53基因替代疗法的主要靶细胞。但是,CAR阴性肿瘤细胞可以逃脱被基于腺病毒的p53替代疗法根除。
为了靶向CAR阴性的肿瘤细胞,使用膜可渗透肽的蛋白转导疗法可能对将外源p53蛋白直接引入肿瘤细胞可能有用。例如,已显示与p53蛋白融合的11个聚精氨酸肽可将p53蛋白引入细胞,随后诱导p21基因启动子的活性,类似于基于Ad-p53的p53基因替代疗法(Takenobu)的诱导等。2002年)。对MDM2介导的泛素化具有抗性的基因修饰的p53蛋白在激活p53下游靶基因的转录方面更有效,与野生型p53蛋白相比,具有更强的抗肿瘤作用(Michiue et al。2005年)。相比之下,将与三个聚精氨酸肽融合的野生型p53蛋白引入经pyr丁酸酯共处理的细胞中可用于诱导p53下游靶基因的转录激活(Hitsuda等。2012年)。此外,通过使用这种蛋白质转导系统,p53蛋白的羧基末端区域显示出可有效诱导人癌细胞的凋亡和自噬作用(Li等。2005年; 上田等。2012年)。这些积累的证据表明,使用聚精氨酸肽的这种蛋白质转导疗法是一种有前途的p53替代疗法,尤其是对于CAR阴性肿瘤细胞。
四、 p53替代疗法的旁观者效应 Bystander Effect of p53 Replacement Therapy
P53替代疗法似乎不仅可以通过引入p53诱导肿瘤细胞诱导细胞死亡,还可以通过旁观者效应的激活诱导周围肿瘤细胞的细胞死亡(Frank等。 1998年)。旁观者效应是一种生物现象,其中未治疗的肿瘤细胞表现出与已治疗的肿瘤细胞相似的抗肿瘤作用。在传统的抗肿瘤治疗中,辐射引起的旁观者效应是通过免疫系统,自由基和炎症反应的激活引起的(Najafi等人。2014年)。在p53替代疗法中,已经显示出Ad-p53治疗在临床前体内情况下通过多种机制诱导对邻近肿瘤细胞的旁观者效应(图 5)。例如,Ad-p53感染会降低包括血管内皮生长因子在内的血管生成因子的表达,并增加抗血管生成因子的表达,从而导致肿瘤组织内的血管生成受到抑制(Bouvet等。1998年; 西崎等。1999年)。相反,免疫反应的激活也参与了由Ad-p53诱导的旁观者效应(图 5)。Ad-p53感染诱导CD95配体的过表达,这会通过Fas受体/配体系统在受感染的肿瘤细胞中引起凋亡(Fukazawa等人。1999年)以及嗜中性粒细胞在含有感染和未感染肿瘤细胞的肿瘤组织中的大量浸润(Waku et al。 2000)。当将骨髓来源的树突状细胞(DC)用作递送Ad-p53的载体细胞时,肿瘤内注射Ad-p53整合的DC在皮下异种移植肿瘤模型中对DC注射和未注射的肿瘤组织均产生抗肿瘤作用(村上等人。2004年)。天然杀伤细胞已被证明是Ad-p53诱导的旁观者效应的免疫介质(Carroll et al。2001)。这些积累的证据表明,p53替代疗法是一种通过旁观者效应介导的肿瘤微环境调节引起高细胞死亡的有前途的抗肿瘤策略。
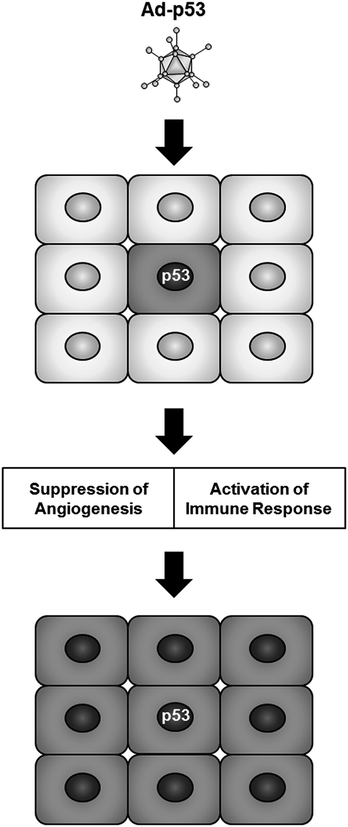
-p53载体感染肿瘤细胞时,p53的异位表达在感染Ad-p53的肿瘤细胞中诱导程序性细胞死亡。此外,在肿瘤微环境中,还可以通过诱导旁观者效应来消除周围未感染的肿瘤细胞,所述旁观者效应包括抑制血管生成和激活免疫反应。
五、结论
P53替代疗法正在成为一种有希望的抗肿瘤策略,用于在肿瘤细胞中强烈诱导p53介导的细胞死亡信号通路。尽管基于脂质体的递送系统是用于体外实验的有用方法,但是在体内实验中,转导效率仍低于基于病毒的递送系统。使用复制缺陷型Ad-p53载体的许多临床研究表明,通过多种方法(包括肿瘤内,腹膜内和膀胱内注射)中的一种来施用Ad-p53载体,对于患有多种疾病的患者是一种安全,可行且有效的抗肿瘤策略癌症类型(Tazawa等2013年)。然而,尽管Ad-p53载体引起肿瘤组织内的旁观者效应,但是Ad-p53介导的p53活化可能不足以诱导整个肿瘤组织中的细胞死亡,因为该病毒是复制缺陷型病毒。为了提高基于腺病毒的p53替代疗法的低转导效率,需要表达p53的具有复制能力的溶瘤性腺病毒OBP-702(Yamasaki等。2012年),最近得到了发展(图 2)。相反,使用膜可渗透的聚精氨酸肽的蛋白质转导疗法也将是将p53引入抗病毒传递的肿瘤细胞中的有用策略。因此,鉴于由各种p53转移方法诱导的p53介导的细胞死亡信号转导途径的潜在分子机制,将来应该有可能开发出更安全有效的p53替代疗法。
参考资料
- Current Strategies in Cancer Gene Therapy pp 1-15. p53 Replacement Therapy for Cancer。https://link.springer.com/chapter/10.1007/978-3-319-42934-2_1
