【3.1.5】紫杉醇(Taxol/paclitaxel)
二、紫杉醇/紫杉醇如何杀死癌细胞
紫杉醇(Taxol)(通用名: paclitaxel)是一种微管稳定药物,已获得美国食品和药物管理局的批准,可用于治疗卵巢癌,乳腺癌和肺癌以及卡波济氏肉瘤。 除肉瘤,淋巴瘤和白血病外,它还用于治疗胃食管癌,子宫内膜癌,宫颈癌,前列腺癌以及头颈癌。 长期以来,人们一直认为紫杉醇可以诱导有丝分裂停滞,从而导致一部分被捕人群的细胞死亡。 然而,最近的证据表明,紫杉醇的肿瘤内浓度太低而不能导致有丝分裂停滞并导致多极分裂。 希望现在可以将这种见解用于开发生物标记物,以识别约50%将从紫杉醇疗法中受益的患者。 在这里,我讨论了紫杉醇的历史以及我们最近对其作用机理的了解。
2.1 TAXOL如何被发现并重命名为PACLITAXEL
在1960年至1981年之间,美国国家癌症研究所(NCI)和美国农业部(USDA)开展了一项植物筛选计划,该计划收集并测试了15,000种植物中的115,000种提取物,以鉴定具有抗癌活性的天然化合物。美国农业部植物学家亚瑟·巴克莱(Arthur Barclay)于1962年探险的最后一天从一棵太平洋紫杉树中提取了紫杉树的样品。他返回后,对树皮,树枝,针叶和果实的粗提物进行了测试,并对树皮提取物进行了测试。被发现具有细胞毒性。曼苏克·瓦尼(Mansukh Wani)和门罗·沃尔(Monroe Wall)与研究三角研究所(北卡罗莱纳州三角公园)的国家癌症研究所(NCI)签订合同,于1964年收到了短叶红豆杉样品。到1967年,他们从短叶红豆杉树皮中分离并鉴定了有效成分。根据其起源物种和羟基的存在,将其命名为紫杉醇(taxol)(Perdue和Hartwell,1969; Wall和Wani,1995)。 1971年,他们发表了紫杉酚的结构(Wani等,1971),并进入了NCI药物开发计划(表1)。

紫杉醇在临床前试验中显示出不同的结果,并且没有被一致认为是最有希望的植物产品。紫杉醇在水中的不溶性使其必须与聚乙氧基化蓖麻油一起配制,这会引起严重的过敏反应并进一步减弱其热情。但是,到1978年,紫杉醇已在包括P388白血病在内的多种小鼠肿瘤模型中显示出疗效(Fuchs和Johnson,1978),并于1984年进入临床试验。
由于紫杉醇的缺乏,一些临床试验被推迟了,当时紫杉醇的唯一来源是缓慢生长的短小T.foevifolia(短叶红豆杉)。尽管缺乏,但仍进行了一项关于卵巢癌的临床研究,并最终得出结论:30%的晚期卵巢癌患者对紫杉醇治疗有反应(McGuire等人,1989)。由于去除树皮杀死了树木,对紫杉醇的高需求导致短叶红豆杉严重枯竭。 1990年,内政部请愿将短叶红豆杉列入濒危物种名单,并于1992年通过了《太平洋紫杉法案》以保护该树。
1988年,据估计,利用现有的短叶红豆杉制造紫杉醇的成本是NCI上该项目可用预算的10倍,并且对短叶红豆杉的长期前景的环境关注也在增长。由于紫杉醇的可及性有限,以及其独特的结构和细胞毒性潜能,全世界至少有30个实验室竞争开发全合成。但是,由于分子的复杂性,这些努力直到1994年才取得成功(Holton等,1994a,b; Nicolaou等人,1994)。最终,开发了几种用于全合成的方法,所有这些方法都需要大约40步反应,并且更实用的半合成方案成为生产的标准方法。然而,在1989年,没有明显的解决方案来立即获得大量的紫杉醇,NCI决定将紫杉醇转移到制药公司进行商业化。申请请求收到了四个答复,Bristol-Myers Squibb(BMS)于1991年被选中。1992年,BMS将商标名“ Taxol”注册为商标,并创建了新的通用名称紫杉醇(paclitaxel)。尽管在过去的20年中,已在600多种手稿中使用了紫杉酚一词,但还是发生了这种情况。
1991年和1993年举行了关于taxol to Taxol and paclitaxel过渡的国会听证会(表1)。听证会质疑授予BMS对自然资源的垄断权,以及对Taxol等药物收取的更高价格的指控,这些药品是通过联邦资金而非私人资金来确定和开发的。小组委员会工作人员得出的结论是,NCI与BMS之间的协议“不足以充分保护公共利益”(美国国会,众议院小企业委员会,法规,商业机会和能源小组委员会,1992年,) 。但是,协议没有实质性更改。紫杉醇是历史上最有利可图的化疗药物,也是植物筛选程序确定的临床上唯一的药物。
2.2 Paclitaxel在体内和体外的基本作用
1977年,NCI将紫杉醇(paclitaxel)(当时仍称为taxol)样品送至艾伯特·爱因斯坦医学院(纽约,纽约)的Susan Horwitz。 1979年,她报道了紫杉醇促进了微管的组装-由α-和β-微管蛋白异二聚体的重复亚基组成的聚合物。紫杉醇降低了体外聚合成微管所需的纯化微管蛋白亚基的临界浓度,并增加了组装的微管蛋白亚基的百分比。此外,在紫杉醇存在下聚合的微管受到保护,不会受到通常通过冷或钙处理引起的分解(Schiff等人,1979)。这些作用与先前确定的微管毒物形成鲜明对比,包括秋水仙碱和长春花生物碱,它们阻止了微管聚合(Malawista和Bensch,1967; Bensch和Malawista,1968; De Brabander等。 ,1981)。
与紫杉醇对纯化微管蛋白的作用相似,紫杉醇可促进活细胞中的微管聚合和稳定,从而能够拮抗秋水仙碱和长春花生物碱的作用(Schiff和Horwitz,1980; De Brabander等,1981)。蓝色的右指向三角形)。从表型上看,紫杉醇治疗可在动物肿瘤模型和细胞培养中阻止有丝分裂中的多种细胞类型(Fuchs和Johnson,1978; Schiff和Horwitz,1980; Milas等, 1995年是; Jordan and Wilson,2004年是; Orth等人,2008年是)。绝大多数报告表明,紫杉醇停滞的细胞处于中期,并包含接近正常的双极纺锤体。紫杉醇治疗的标准图像显示细胞在细胞赤道处具有对齐的染色体,尽管在某些情况下,据报道一个或几个染色体仍然未对齐(Jordan等,1993,1996;沃特斯(Waters)等人,1996年,)。少数研究报道某些浓度的紫杉醇可诱发多极纺锤体(Chen and Horwitz,2002年蓝色右角三角形; Hornick等人,2008年蓝色右角三角形)。但是,直到最近,还没有证据表明这些作用与临床有关。迄今为止,主要的看法是紫杉醇的抗肿瘤作用是由于其能够将细胞停滞在双极纺锤体的中期。
紫杉醇诱导的有丝分裂阻滞是由于有丝分裂检查点(也称为纺锤体组装检查点)的激活而发生的,有丝分裂检查点是有丝分裂期间主要的细胞周期控制机制,可防止染色体错集。有丝分裂检查点延迟了染色体的分离,这些染色体以姊妹染色单体的复制对形式进入有丝分裂,直到每对染色体都牢固地附着在有丝分裂纺锤体的两个极上。这种安排确保每个子细胞将收到每个染色单体的一个副本。染色单体通过其动粒体连接到纺锤体微管,这些动植物是在DNA着丝粒区域组装的蛋白质复合物。未附着到微管的未连接动植物通过抑制促后期合成物/环体激活信号转导级联反应,从而延迟有丝分裂进程(Kops等,2005; Lara-Gonzalez等, 2012; Foley和Kapoor,2013)。紫杉醇处理由于存在少量未附着的动植物而将细胞停在有丝分裂中(Waters等,1998)。
紫杉醇除可用于癌症治疗外,还广泛用于细胞生物学中。在未经处理的细胞中,姐妹染色单体的双极附着使动子体处于张力下,这有助于稳定动子体与纺锤体微管之间的相互作用。紫杉醇处理可减轻保持双极附着的动植物的张力(Waters等,1998),是一种有用的工具,既可将细胞停滞在有丝分裂中,又可将张力与附着的作用分开,从而满足有丝分裂检查点(Maresca和Salmon,2010年)。
2.3 研究Paclitaxel机理的挑战
在PubMed中搜索紫杉醇(或紫杉醇)可返回约25,000篇文章。尽管有大量文献,但直到最近,用于细胞培养研究的临床相关浓度仍不清楚。有几个原因。
- 首先,根据疾病和所选择的化疗方案,紫杉醇按不同的水平和时间表给药。
- 第二,随着药物的清除,血浆中紫杉醇的浓度会随着时间而变化,主要是通过肝脏清除。
- 第三,紫杉醇在癌细胞系中在细胞内累积50倍至> 1000倍,这取决于细胞类型和添加的浓度(Jordan等,1993,1996; Yvon等。 ,1999)。因此,紫杉醇在肿瘤中的浓度几乎肯定比通常在血浆中测量的血浆中更高,但是没有线性计算来预测倍数浓度。
- 第四,肿瘤内测量需要在治疗开始后进行活检,这在临床试验之外是不容易获得的。
在缺乏确定紫杉醇在肿瘤内浓度的数据的情况下,有理由推断其抗肿瘤作用是由于有丝分裂阻滞。不幸的是,确定有丝分裂阻滞细胞的命运并不容易。有丝分裂停滞导致有丝分裂期间死亡或有丝分裂的异常退出,而没有染色体分离或胞质分裂,形成四倍体G1细胞。此出口称为有丝分裂滑移。滑动后,细胞可能死亡,停滞或继续循环。决定有丝分裂停止后决定细胞命运的因素仍然未知。
经常牵连对有丝分裂停滞的反应的因素之一是有丝分裂检查点。许多小组已经报告了有功能的有丝分裂检查点,是有效细胞杀灭有丝分裂阻滞所必需的。相反,据报道有丝分裂检查点减弱的细胞对紫杉醇敏感。还有其他研究发现,有丝分裂检查点的状态不会影响这种敏感性(Rieder和Maiato,2004年; Weaver和Cleveland,2005年; Yamada和Gorbsky,2006年) ; Ryan等人,2012年,)。一些人假设弱化的有丝分裂检查点仅赋予对有丝分裂阻滞的短期抵抗力(Janssen等,2009),而另一些人则提出激活有丝分裂检查点后再进行有丝分裂滑动可导致最佳的细胞杀伤(Tao等人,2005年,)。一种流行的假设是,有丝分裂停滞的持续时间可预测细胞死亡,而停滞时间更长的细胞更有可能死亡。但是,多项观察单个细胞的研究表明,细胞在有丝分裂中所用的时间长度无法预测其是否会存活(Gascoigne和Taylor,2008; Orth等人,2008; Altho等人,2008; Altho等,2008蓝色指向右三角形)。 Shi等,2008)。
使用非转化的,染色体稳定的细胞的研究进一步证明了预测对有丝分裂阻滞的敏感性的困难。延时显微镜用于鉴定正常双极分裂而没有染色体错失的姐妹细胞。出乎意料的是,响应有丝分裂停滞的姐妹细胞的命运是完全不相关的。如果一个细胞死于有丝分裂,那么它的姊妹死于有丝分裂的可能性就不如滑入相间(死或存活)。因此,响应有丝分裂停滞的细胞命运是随机的,而不是遗传决定的(Gascoigne和Taylor,2008)。
2.4 交互作用的交替假设 ALTERNATE HYPOTHESIS OF INTERPHASE ACTION
过去几十年的主要假设是紫杉醇由于有丝分裂阻滞而杀死肿瘤细胞。然而,尽管足以导致细胞死亡的对有丝分裂的显着影响,紫杉醇仍通过对相间细胞的影响而在肿瘤中引起死亡。该提议主要基于以下观点:肿瘤中的有丝分裂指数不足以解释紫杉醇的疗效。人类肿瘤的倍增时间很慢,并且根据肿瘤倍增率预测有丝分裂指数的计算(不考虑细胞死亡)表明,在存在紫杉醇的情况下,没有足够数量的细胞通过有丝分裂来解释肿瘤的收缩率(Komlodi- Pasztor et al。,2011,2012; Mitchison,2012)。但是,在许多未治疗的患者肿瘤中都观察到细胞死亡,直接测量的增殖率远高于根据肿瘤加倍率估计的增殖率(Kerr和Searle,1972; Kerr等,1972)。; Searle等人,1973; Lowe和Lin,2000)。此外,紫杉醇在肿瘤中保留的时间超过5天(Mori等人,2006; Koshiba等人,2009),从而使细胞经历一个或一个以上的时间窗口成为可能。在存在药品的情况下进行更多轮分裂。
从机制上讲,尚不清楚紫杉醇如何在不影响先前的有丝分裂的情况下使间期细胞死亡。有人假设紫杉醇可能会干扰细胞信号传导,运输和微管介导的转运(Herbst和Khuri,2003; Komlodi-Pasztor等人,2011)。但是,在细胞培养中,临床相关水平的紫杉醇不会在药物作用下的先前未经历有丝分裂的相间细胞中引起死亡(Janssen等人,2013; Zasadil等人,2014蓝色右指) -指向三角形)。有趣的是,在使用活体显微镜观察的肿瘤模型中,用紫杉醇剂量治疗后有望导致有丝分裂停滞的有丝分裂指数非常低(Orth等人,2011; Janssen等人,2013蓝色右指向指向三角形),这提示微环境允许紫杉醇表现出在培养物中未观察到的相间作用。但是,尚未出现明确的细胞毒性机制。
2.5 临床上浓度高的Paclitaxel导致多极分裂
为了更好地模拟紫杉醇在细胞培养中的抗肿瘤作用,我们首先与我们的医师同事合作设计了一项临床试验,以测量紫杉醇在原发性乳腺肿瘤中的肿瘤内浓度(Zasadil等人,2014)。为了消除尽可能多的混淆变量,招募了未接受过既往治疗且不需要同时治疗的患者。在首次剂量175 mg / m2紫杉醇开始后20小时,获得样品以测量血浆和肿瘤中紫杉醇的浓度。之所以选择20小时的时间点,是因为在紫杉醇给药后16至32小时之间,培养物中乳腺癌细胞的有丝分裂指数增加了15倍以上,因此我们预测在此时间点上有丝分裂阻滞将是明显的。为了评估肿瘤是否有反应,在紫杉醇治疗前和四个标准周期后通过超声和/或乳房X线照片进行测量。
如先前的细胞培养实验所预测,在所有患者中,紫杉醇的肿瘤内浓度(1–9μM)高于血浆浓度(80–280 nM)。然而,与基于细胞培养数据的预期相反,有丝分裂阻滞对于响应紫杉醇的肿瘤萎缩既不是必需的也不是充分的(Zasadil等人,2014)。
作为确定适当紫杉醇剂量来处理我们培养的细胞的第二步,我们确定了药物在乳腺癌细胞系中的浓缩程度。与以前的结果一致(Jordan等,1993,1996; Yvon等人,1999),我们发现紫杉醇在不同的细胞系中积累的程度不同。高效液相色谱分析确定,使用低纳摩尔浓度的紫杉醇(MDA-MB-231为5-10 nM,Cal51为10-50 nM)进行治疗,可使临床上相关的细胞内浓度为1-9μM。
令人感兴趣的是,尽管较高的药物浓度在这些乳腺癌细胞系中引起了有力的有丝分裂停滞,但临床上相关的浓度却没有。但是,它们确实会诱发多极纺锤体的形成。重要的是,用紫杉醇治疗的患者肿瘤中的大多数有丝分裂细胞也表现出多极纺锤体。经过短暂的延迟后,具有临床相关浓度的紫杉醇的培养细胞会通过多极纺锤体上的有丝分裂进行,并经常沿三个,四个或五个不同方向分离其染色体。但是,一部分细胞动力学犁沟通常会失效,并且紫杉醇中的大多数分裂会产生两个或三个子细胞(图1; Zasadil等人,2014)。
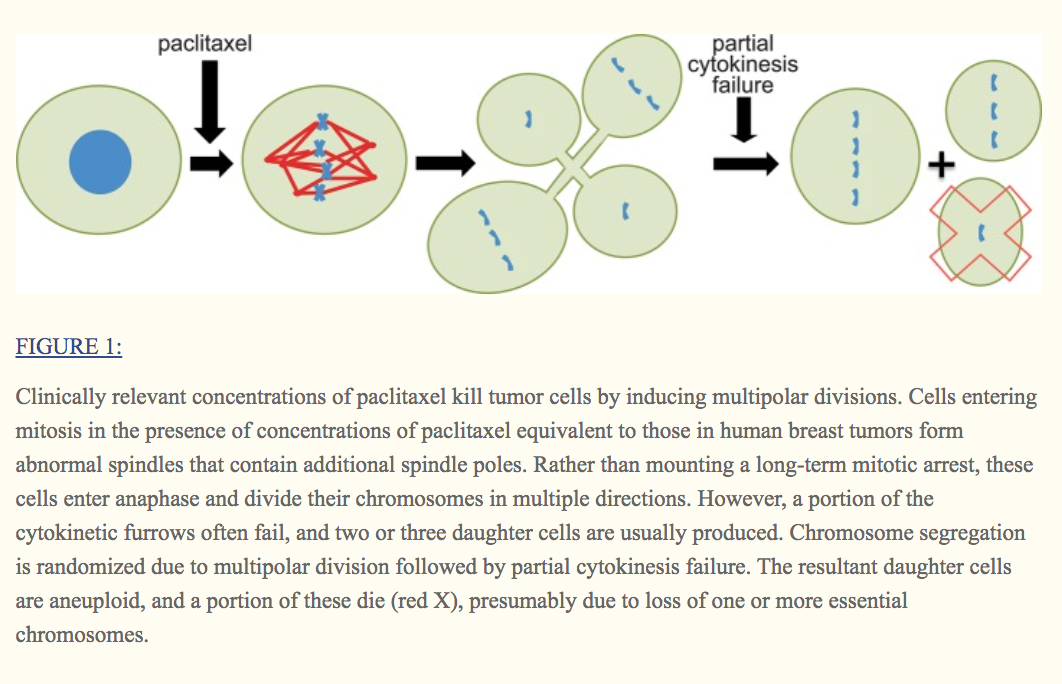
2.7 含义 IMPLICATIONS
由于紫杉醇以通常用于培养的浓度导致有丝分裂停滞,并且据信在人类肿瘤中也是如此。因此,许多其他诱导有丝分裂停滞而不影响微管动力学的药物已进入临床试验。这些包括Aurora A,CENP-E,Eg5 / KSP和Plk1的抑制剂。对这些药物的期望是,它们将具有紫杉醇的疗效,而没有紫杉醇的主要剂量限制性毒性之一-周围神经病变。紫杉醇治疗后的周围神经病变被认为是由于沿身体最长轴突的运输受损所致,尽管目前尚无相关数据,而且某些不影响微管的化学疗法药物(如cisplatin)也会引起相同的症状。令人失望的是,尽管引起了有丝分裂图的积累,但新型抗有丝分裂药物尚未达到紫杉醇的疗效(Chakravarty等人,2011; Komlodi-Pasztor等人,2011) ; Mitchison,2012年)。这可能是因为紫杉醇对患者肿瘤的细胞毒性作用是诱导多极分裂而不是有丝分裂阻滞。
已经进行了许多筛选来鉴定对紫杉醇的抗性或敏感性的标志物。这些已经确定了各种各样的候选物,包括蛋白酶体亚基,细胞周期蛋白G1和溶质载体基因(Rouzier等人,2005年; Swanton等人,2007年; Whitehurst等人, 2007; Pusztai等人,2009; Juul等人,2010; Wertz等人,2011; Njiaju等人,2012; Russell等人,2012)。然而,这些发现尚未导致可预测哪些患者将从紫杉醇治疗中受益的生物标志物。这可能至少部分是由于对导致有丝分裂阻滞和细胞快速死亡的较高浓度药物的强调。希望对紫杉醇临床相关机制的认识将有助于鉴定能够预测哪些患者将从其使用中受益的生物标记物。
2.8 结论
像所有药物一样,紫杉醇表现出浓度依赖性作用。 毫不奇怪,最初认为较高的紫杉醇浓度对有丝分裂和细胞死亡具有迅速而显着的作用,是其在癌症治疗中的功效的原因。 不幸的是,基础科学家获取患者样品的障碍大大延迟了发现较低的浓度(其较慢引起细胞死亡)与临床相关的发现。 然而,最新的数据表明,紫杉醇的肿瘤内浓度不是导致有丝分裂停滞,而是由于多极纺锤体上的染色体错聚引起细胞死亡。 希望除了加速鉴定紫杉醇治疗的预测性生物标志物外,这种见解还将鼓励基础科学家和临床医生之间的合作。
参考资料
-
- How Taxol/paclitaxel kills cancer cells. https://academic.oup.com/abt/article/3/4/237/6004960
