【7.7.1.6】c-MET
一、 MET基因介绍
MET基因又称间质上皮转化因子(Mesenchymal to epithelial transition factor),位于7号染色体长臂,主要在质膜上表达,基因结构主要包括Sema结构域、近膜结构域及激酶结构域等。c-MET作为跨膜蛋白,分为胞外区、跨膜区以及胞内区。胞外区仅包含α亚基,跨膜区和胞内区包含α亚基和β亚基,并且α亚基和β亚基依靠二硫键形成异二聚体,组成c-MET跨膜蛋白受体。简言之,MET基因表达形成了c-MET蛋白。
1991年Bottaro等首次发现肝细胞生长因子(HGF,Hepatocyte growth factor)作为c-MET蛋白的配体,同时也确立了HGF/c-MET信号通路的形成,为今后该信号通路的探索开创了先河。HGF作为c-MET蛋白的配体,主要表达在间充质细胞和成纤维细胞旁分泌因子,也可能在某种特定的情况下在非激活状态下的肿瘤细胞产生,通过二聚化或二磷酸化进行激活,同时与c-MET蛋白受体结合,激活酪氨酸激酶,进一步激活下游信号通路(PI3K-AKT通路、RAS-MAPK通路、JAK-STAT通路以及WNT通路),同时这些通路的激活与肿瘤的发生和发展密切相关。
二、MET基因突变类型以及致癌机制
基因突变主要包括单核苷酸突变(SNV)、短片段插入或缺失(Indel)、拷贝数变异(CNV)以及基因融合(SV)。针对MET基因突变,以上几种突变情况均有存在。在乳头状肾细胞癌中发现胚系或体细胞突变,以及在肺肉瘤样癌一种独立的分子亚型中,出现一种罕见的外显子剪接突变—MET exon14跳跃突变等。SNV突变如图1所示:
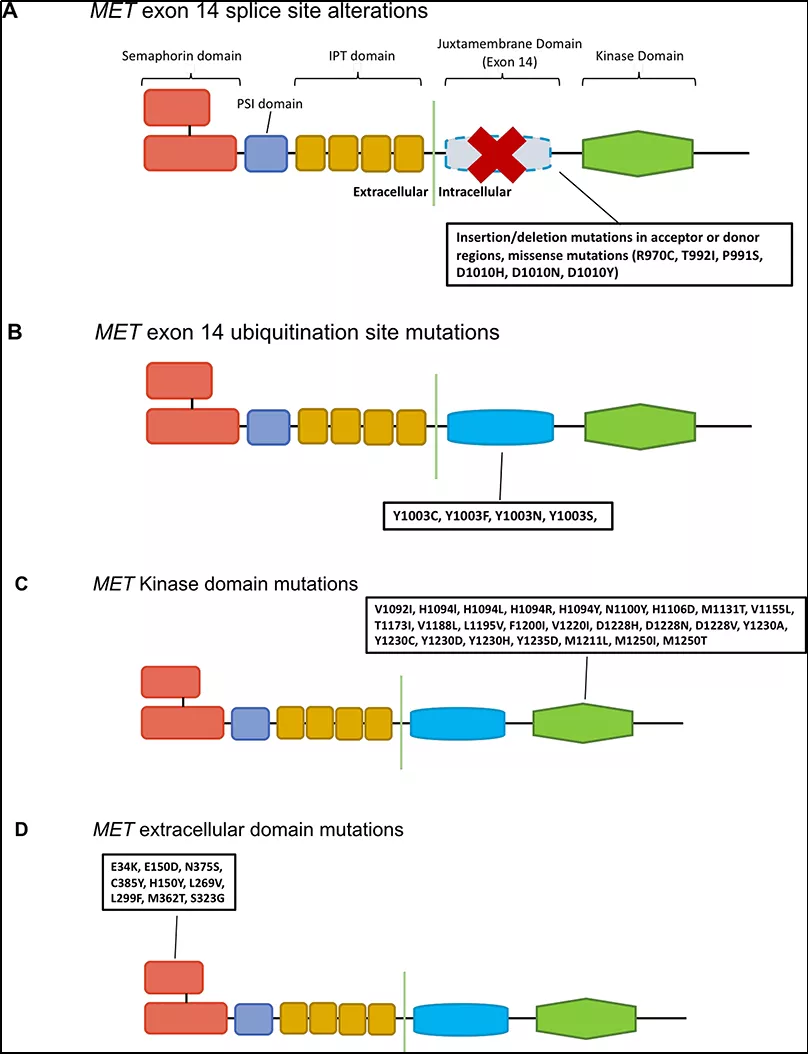 图1: MET基因不同结构域突变示意图
图1: MET基因不同结构域突变示意图
其中,SNV包括MET exon14附近区域的突变,在RNA前体剪接形成mRNA时,主要影响到剪接供体或受体的改变导致exon14被剪掉的情况(图1A);还包括MET exon14 Y1003位点的突变(图1B),作为CBL直接结合位点,CBL是E3-泛素连接酶,可促进c-MET蛋白降解。当c-MET蛋白需要进行泛素化降解时,c-CBL 酪氨酸激酶结合域(TKB)和MET基因上近膜结构域酪氨酸残基(Y1003)结合,导致c-MET蛋白降解;当该区域缺失时,会导致c-MET受体泛素化降低,c-MET蛋白降解降低,最终导致下游信号通路的持续激活,从而导致肿瘤发生。除此之外,一些MET基因激酶结构域的SNV影响了激酶的激活(图1C),可能与MET激酶抑制剂耐药机制相关;还有一些位于MET基因胞外结构域的突变(图1D),对MET激活方式仍存在争议。
相关MET exon14跳跃突变研究统计,共933例非鳞状的非小细胞肺癌中,存在28例(3%)患者发生MET exon14突变,并且MET exon14跳跃突变定义了非小细胞肺癌的独特分子类别。其机制与Y1003突变类似,MET exon14 跳跃突变导致CBL直接结合位点丢失,最终导致c-MET蛋白积累与信号途径激活。28名患者均对MET exon14外显子剪接供体和剪接受体产生了影响,发生了MET exon14跳跃突变,如图2所示:
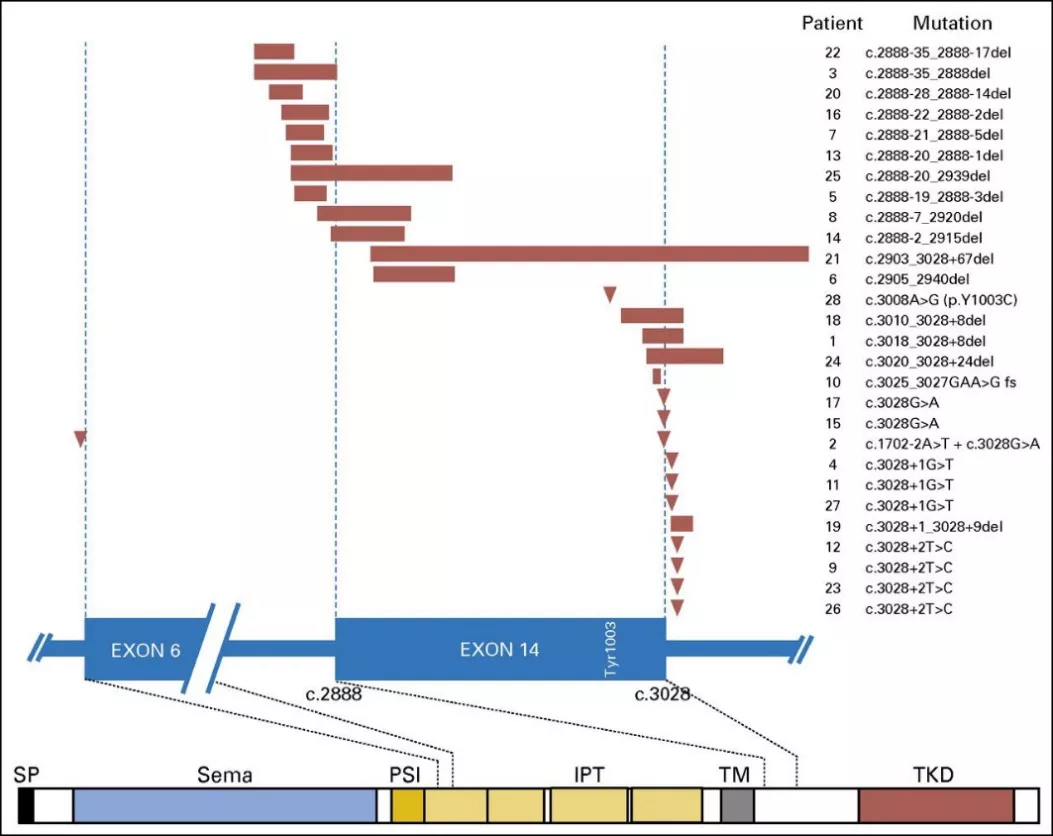
图2:28例肺癌患者携带MET基因的突变位点
其次,早在1984年Cooper等在骨肉瘤细胞系中发现与TPR基因融合,形成第一个MET/TPR融合蛋白,并且基于此项研究,首次确认MET基因为原癌基因。除此之外,有相关融合伴侣在文章中报道,如图3所示:
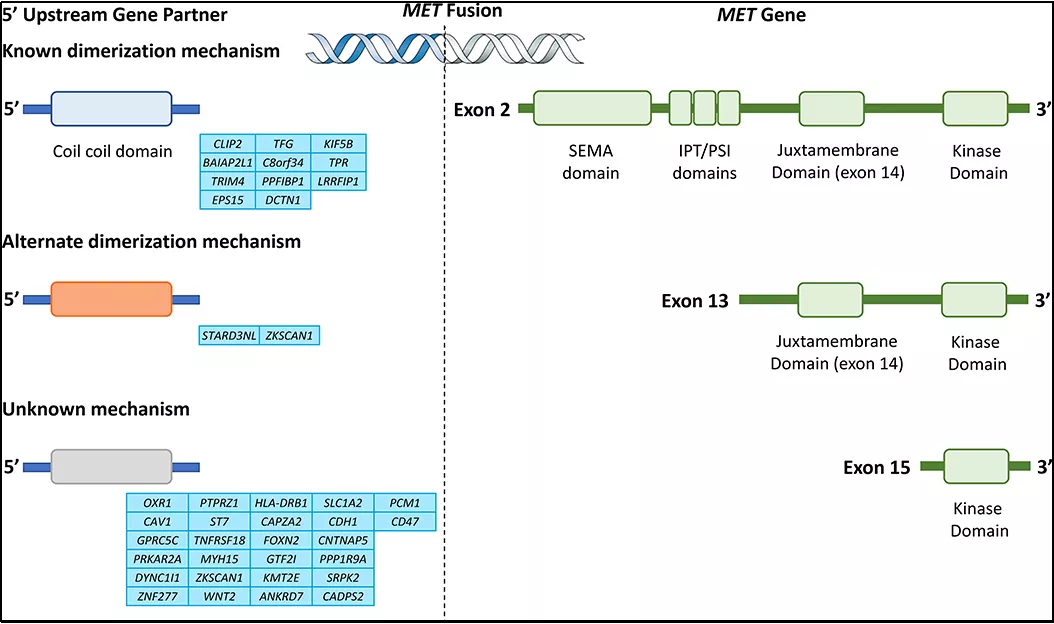 图3:MET基因融合伴侣断点区域示意图
图3:MET基因融合伴侣断点区域示意图
MET融合在不同癌种中均有发生,主要有乳头状肾细胞癌、低级别脑胶质瘤、肺癌、肝癌以及甲状腺癌等,并且不同的融合断点的位置与MET基因激活方式不同,如图4所示:
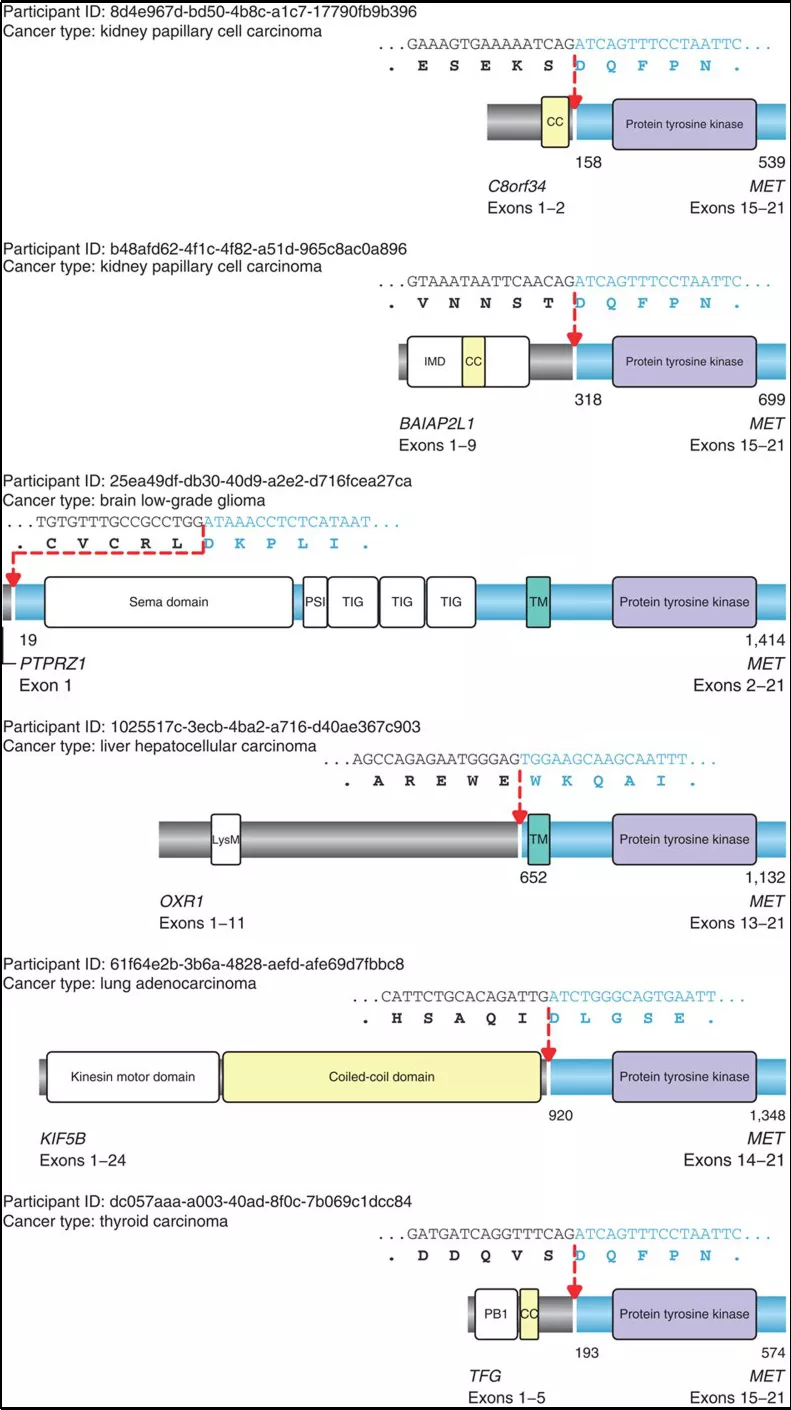
图4:不同癌症中MET基因融合断点
部分融合依赖于该基因exon14的丢失,激活途径与exon14跳跃激活途径类似;另一部分融合则为直接通过融合exon14以外的激酶结构域,导致配体非依赖性组成MET活化,最终影响MET基因表达的增加导致癌症的发生与发展。更惊奇的发现,后者融合致癌活性高于前者。
MET基因拷贝数增加,在胃癌、乳头状肾细胞癌以及对EGFR酪氨酸激酶抑制剂(TKI)耐药的肺癌等发生频率较高,主要是通过基因拷贝数增加,导致c-MET蛋白表达的积累,受体活化,最终导致信号途径的激活。检测基因扩增的方法主要是荧光原位杂交法(FISH)或第二代测序(NGS),都可作为MET基因CNV检测的方法。MET基因扩增如图5所示:

图5:MET基因拷贝数扩增示意图
MET基因扩增作为肺癌获得性耐药的重要机制之一,占比为5-20%,一般预后可能不佳。相关研究表明,NSCLC EGFR TKIs耐药机制是基于c-MET蛋白过表达,诱导ERBB3 (HER3) 活化,进一步激活PI3K/AKT,从而使EGFR TKIs发生耐药。除此之外,在乳头状肾细胞癌、胃癌、肝癌等癌种中,也有相关基因扩增的报道。
三、MET抑制剂获批适应症
在NSCLC中,针对MET exon14跳跃突变,美国食品药品监督管理局(FDA)已有两款MET抑制剂获批,分别为诺华公司的卡马替尼(capmatinib)和默克公司的特泊替尼(Tepotinib)。
四、四、小结
目前,c-MET靶点在不同的癌种中存在各种类型的突变,其突变最终影响是基于c-MET蛋白过表达来进一步激活下游信号通路以及致癌性转化,最终导致癌症的发生与发展。c-MET小分子抑制剂对依赖HGF/c-MET信号途径激活的肿瘤细胞具有明显的抑制作用,同时也是肿瘤患者对抗癌症的重要武器。
略
参考资料
