【7.7.1.5】Claudin18.2
一、靶点机制
紧密连接蛋白(Claudins)最早由日本京都大学的 Mikio Furuse 和 Tsukita Shoichiro 于 1998 年首先发现并命名,Claudins 来源于拉丁文 claudere(关闭),表明这些蛋白质具有 屏障作用。Claudins 是一种小分子(20~24/27kD)四次跨膜蛋白,广泛存在于从线虫到 人类的许多生物中。它们都具有非常相似的结构,N 末端和 C 末端均位于细胞质中,由 一排排蛋白质颗粒组成紧密连接,这些蛋白颗粒形成连续的纤维,将相邻细胞间的空隙封闭上,只允许水分子和离子从衔接处的小孔透过,而使大分子物质难以穿过,Claudins 参 与机体细胞旁通透性和电导的调节。
CLDN18 是 Claudin(CLDN)蛋白家族的成员,其有 CLDN18.1 和 CLDN18.2 两种异构体。CLDN18.2 蛋白的表达具有组织特异性,在正常生 理状态下,CLDN18.2 仅在胃黏膜上已分化的上皮细胞中表达,在其他的健康组织中均无 表达;但在胃癌、胰腺癌高表达,乳腺癌、结肠癌、肝癌等原发性恶性肿瘤中也较高表达。 同时,CLDN18.2 基因也会出现异常激活,高度选择性、稳定地表达于特定肿瘤组织,参 与肿瘤细胞的增殖分化和迁移,这使 CLDN18.2 成为潜在的抗肿瘤药物有效分子靶点。目 前,全球针对 CLDN18.2 为靶点的产品类型包括单克隆抗体、双特异性抗体、CAR-T 细 胞治疗和 ADC。
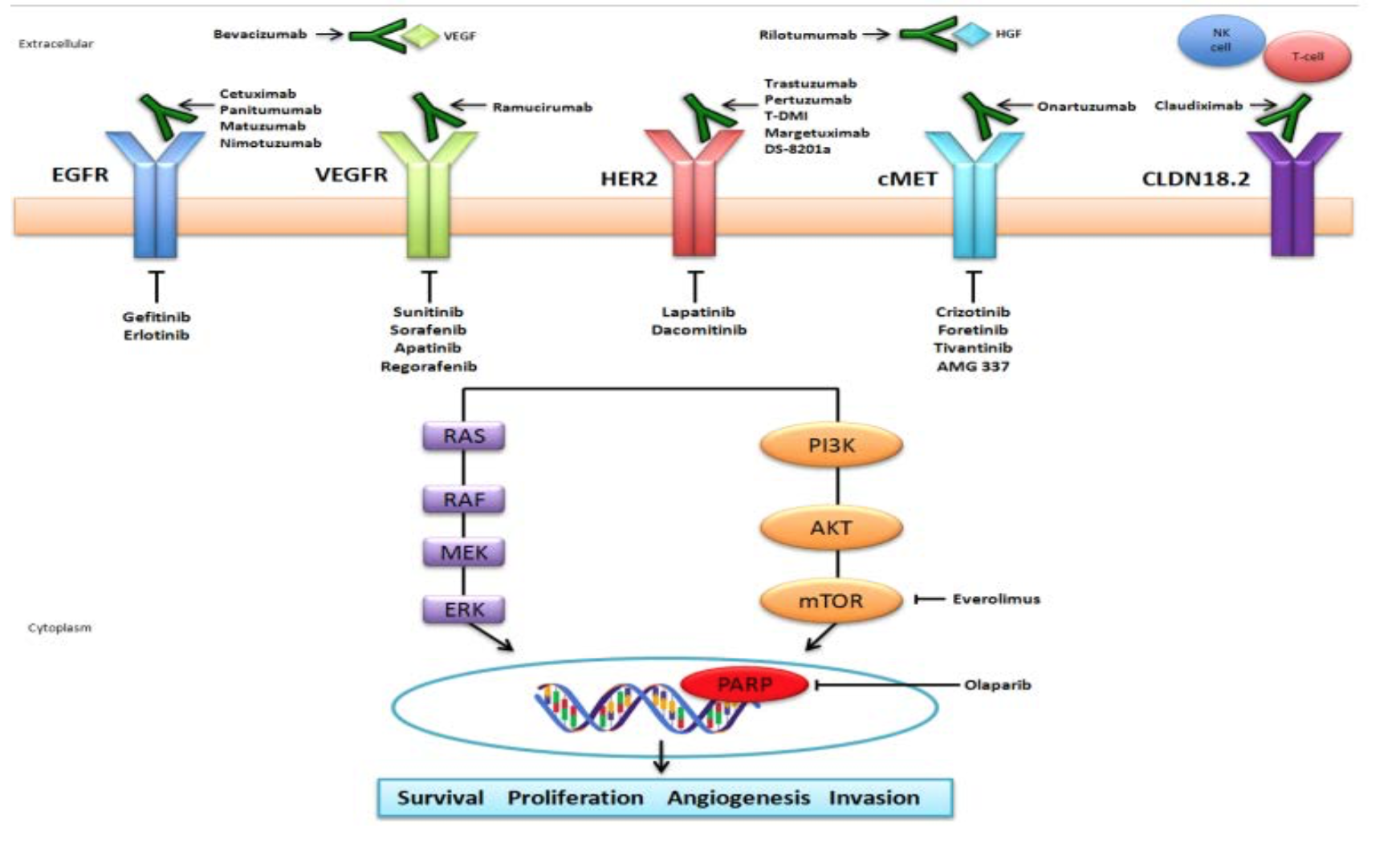
资料来源:Lyons TG,Ku GY.Systemic therapyfor esophagogastric cancer:targeted therapies[J]. Chin Clin Oncol,2017,6(5):48.doi:10.21037/cco.2017.07.02.PMID:29129088.
二、临床研究申报概况
目前靶向 CLDN18.2 的生物药在中国开展的临床研究申报已经超过 30 项,涉及 30 余 款药物。
(1)单抗类药物
2022 年,进展最快的 CLDN18.2 单抗仍然是安斯泰来/Ganymed Pharmaceuticals 的 Zolbetuximab。目前,该药物已进入III期临床试验,包括探索 CAPOX(卡培他滨 +奥沙利铂)±Zolbetuximab 在 CLDN18.2 阳性/HER2 阴性晚期/转移胃癌/胃食管交 界腺癌患者中作为一线治疗的 GLOW 研究(NCT03653507);探索 mFOLFOX6(奥 沙利铂+四氢叶酸+氟尿嘧啶)±Zolbetuximab 在 CLDN18.2 阳性/HER2 阴性晚期/转移胃癌/胃食管交界腺癌患者中作为一线治疗的 SPOTLIGHT 研究(NCT03504397)。其中, 尽管具体数据尚未披露,安斯泰来已宣布 SPOTLIGHT 研究达到了无进展生存期和总生存 期的终点,并表示即将发表具体结果。其他临床试验包括国内开展的 Zolbetuximab+吉西 他滨/白蛋白紫杉醇治疗 claudin18.2+转移性胰腺癌II期国际多中心临床试验正在进行。其 他 claudin18.2 单抗,包括奥赛康 ASKB589、礼新医药 LM-102 的I/II期临床试验正在进 行,其他 CLDN18.2 单抗包括明济生物 M108、信达生物 IBI360、君实生物 JS012、再鼎 医药 ZL-1211、道尔生物 DR30303、宝船生物 BC008 正在进行I期临床试验。由于将 CLDN18.2 作为肿瘤相关抗原(tumor associated antigen,TAA)进行药物开发,除常规单 抗外,还有增强 ADCC 效应的工程化抗体,如天广实 MIL93、石药集团 NBL-015、博安 生物 BA1105 正在开展I期临床试验。
(2)ADC 类药物
比起单抗类药物,CLDN18.2 ADC 整体处于更早期的开发阶段。恒瑞医药 SHR-A1904、 礼新医药 LM-302、荣昌生物 RC118 正在进行I/II期临床试验,乐普生物/康诺亚 CMG901、 石药集团 SYSA1801、荣昌生物 RC118、科伦博泰 SKB315、君实生物 JS107、信达生物 IBI343 均正在进行I期探索。
(3)双特异性抗体
随着抗体工程的发展,越来越多以双特异性抗体为代表的多特异性抗体逐渐崭露头 角。CLDN18.2 双特异性抗体主要分为 CLDN18.2/CD3 T 细胞衔接器(T cell engager,TCE)、 CLDN18.2/4-1BB 共刺激重定向双抗和 CLDN18.2/PD-L1、CLDN18.2/CD47 共抑制重定向 双抗。安进/百济神州的 CLDN18.2/CD3 TCE AMG 910 的I期临床试验已在 2022 年下半年 完成,因效果不及预期已终止开发并从管线剔除。信达生物的 CLDN18.2/CD3 TCE IBI389± 信迪利单抗、齐鲁制药 QLS31905 的I期临床试验正在进行。启愈生物 CLDN18.2/PD-L1 双 抗 Q-1802、普米斯 CLDN18.2/4-1BB 双抗 PM1032 和宝船生物 CLDN18.2/CD47 双抗 BC007 的I期临床试验正在进行。CLDN18.2 是否能作为多特异性抗体靶点获得出色表现 仍有待观察。
(4)CAR-T 细胞治疗
科济药业的 CT041 自体 CAR-T 细胞注射液在消化系统癌症患者中的安全性、有效 性、药代动力学和免疫原性的I期临床试验中期结果已经公布。客观缓解率和疾病控制率 分别达到 48.6%和 73.0%。持续 6 个月的缓解率为 44.8%。在胃癌患者中,客观缓解率和 疾病控制率分别达到 57.1%和 75.0%,6 个月总生存率为 81.2%。表明 CT041 在经过大量 预处理的 CLDN18.2 阳性消化系统癌症患者中,尤其是在胃癌患者中具有良好的效应和 可接受的安全性。目前正在开展 CT041 的多项I期和 I/II期临床试验。信达生物和东阳 光紧随其后正在分别开展 IBI345 和 HEC-016 的I期临床试验。
三、简评
随着安斯泰来的 CLDN18.2 单抗获得成功,CLDN18.2 作为消化系统 TAA 进行药物 开发越来越受到重视,因此,国内针对 CLDN18.2 的研究和药物开发比前一年竞争更加激 烈。目前最佳的临床效应仍然仅在单抗和 CAR-T 细胞治疗上观察到,若 Zolbetuximab III 期临床数据优秀,则可能会在 2023~2024 年被批准上市。创新药物形式 ADC 和多特异 性抗体是否能为 CLDN18.2 增色仍不明朗。鉴于开发难度,大多数后入场者还是针对单抗 进行攻坚开发。抗体工程和结合表位的具体选择可能为单抗的更高的亲和性、靶点占有率 和效应提供优势。作为一个 TAA 抗体,后续可能会涌现出与其他 TAA 抗体一样的耐药等 问题,联合多种疗法是一个可以探索的方向。
参考资料
- 《2021年度中国抗肿瘤新药临床研究评述》
