【7.8.1.3】LAG-3(CD223)
由于肿瘤细胞可借助免疫检查点受体躲避免疫系统的识别和杀伤, 使得阻断免疫检查点受体成为近年来肿瘤免疫治疗的新思路。目前开发较为成熟的受体靶点包括程序性死亡蛋白1及其配体(PD-1/PD-L1)和细胞毒性T淋巴细胞相关抗原-4(CTLA-4), 但由于在其相关抗体治疗过程中患者出现耐受, 新靶点的寻找与开发成为新的研究热点。
LAG-3全称为淋巴细胞活化基因3(Lymphocyte Activation Gene-3),又称CD223,主要功能是负调控T细胞的功能,属于免疫球蛋白超家族成员。LAG-3分子最早于1990年被发现,首次分离出LAG-3分子的cDNA克隆, 同年发现该分子的免疫调控机制, 并于1992年证实主要组织相容性复合体II类分子(MHC II) 为LAG-3的主要配体。LAG-3分子可负向调节T细胞, 在维持机体免疫系统稳态和促进肿瘤免疫逃逸方面扮演重要角色。作为新靶点之一,LAG-3在肿瘤免疫治疗方面存在巨大潜力[1]。
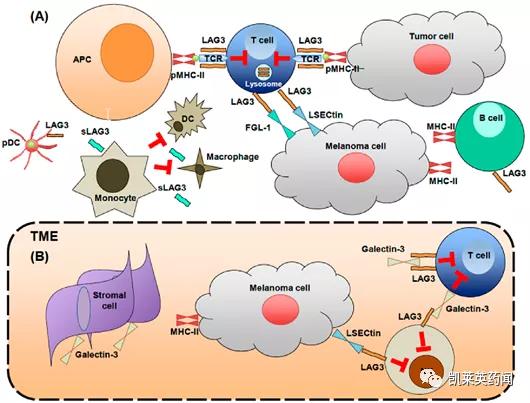
LAG-3在多种实体瘤的肿瘤浸润淋巴细胞(TIL)中存在高表达,这些耗竭的CD4+和CD8+TIL表达的细胞因子明显减少。一项对肝癌患者的研究表明人肝癌组织特异性T细胞上LAG-3的表达明显高于无肿瘤肝组织和外周血[2]。LAG-3的阻断可以增强TIL的增殖以及细胞因子的分泌,增强抗肿瘤免疫。阻断LAG-3的临床前癌症治疗模型表明,肿瘤部位的抗原特异性T细胞活化增强,肿瘤生长受到抑制,并且破坏了肿瘤实质部分[3]。LAG-3在人胶质母细胞瘤样品的TIL和与肿瘤相关的血管周围淋巴细胞上表达,单独使用LAG-3或与抗PD-1组合使用,在根除胶质母细胞瘤小鼠方面非常有效[4]。对黑色素瘤,结直肠癌和非小细胞肺癌患者研究发现外周血和肿瘤组织中的Treg细胞上都表达了LAG-3,这种表达LAG-3的Treg细胞产生高水平的免疫调节细胞因子IL-10和TGF-β,并抑制TIL的活化[5]。LAG-3参与了类似PD-1的肿瘤免疫逃逸机制,目前针对LAG-3的免疫治疗开发出的主要抑制方法:LAG-3-Ig融合蛋白和靶向LAG-3的单抗/双抗。
参考资料
