【7.7.2.3】VEGF(VEGFR)
一、血管生成机制
血管生成(Angiogenesis)是一种在机体组织原有脉管系统的基础上生成新的血管和淋巴管的过程,该过程在胚胎发育、伤口愈合等机体机能中发挥重要功能。 血管生成机制在体内被严格的控制,通常通过促血管生成因子群和抗血管生成因子群的平衡来对其进行调控。在病理状态下,该平衡状态被打破,血管生成机制不受到抑制,出现血管的过度增生。
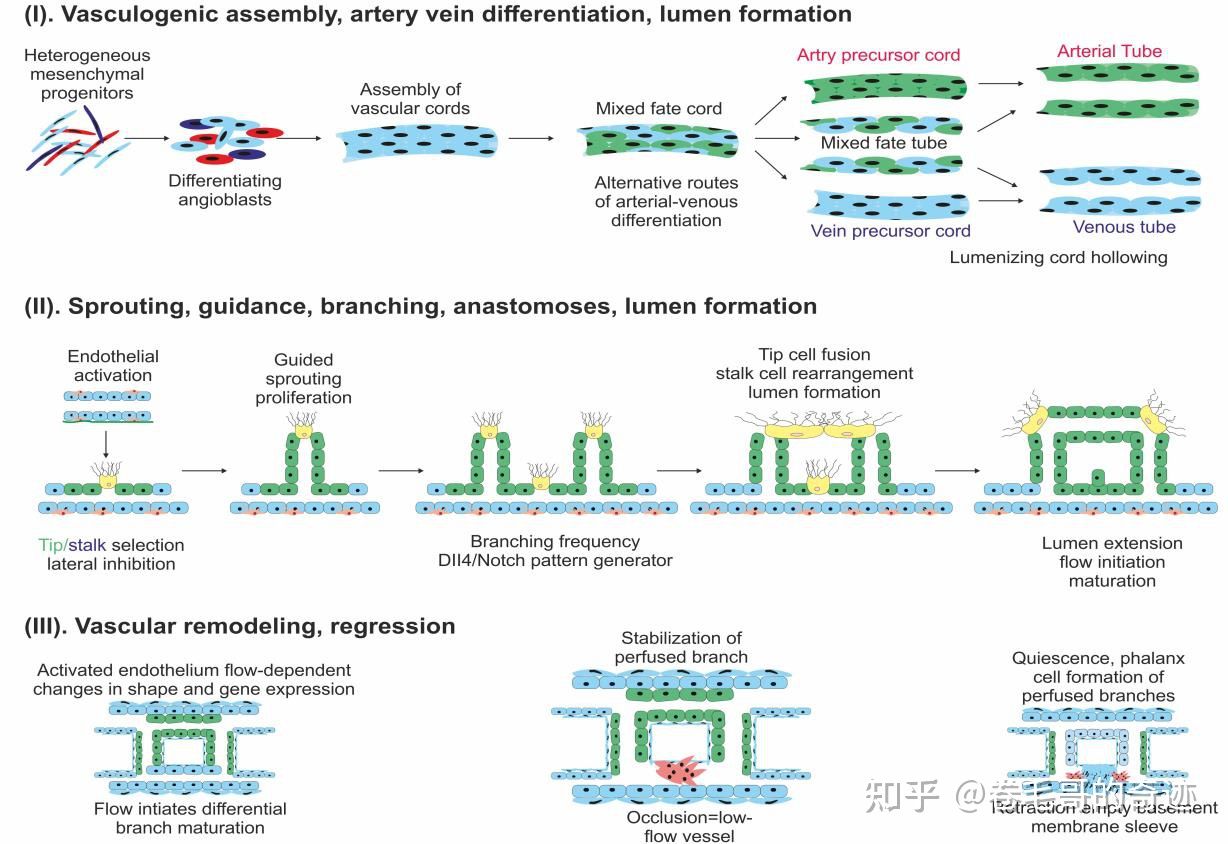
正常机体血管生成的生物学步骤。
- I:血管母细胞(angioblasts)分化成内皮细胞(Endothelial cell,EC);
- II:内皮细胞被激活,通过Tip细胞在原来脉管的基础上进行出芽,随着Tip细胞引导的出芽作用的进行,新生血管分支不断形成,相邻的血管分支通过Tip细胞的引导发生交汇并融合,最终形成了新生的血管组织;
- III:新生的血管从初级的结构逐渐发育成成熟的脉管丛。
二、肿瘤的血管生成
肿瘤细胞是人体内异常增殖的细胞,生长速度快,为了满足代谢机能的需求,需要新生血管为肿瘤细胞的生长带来充足的养料和氧气,同时带走代谢废物和毒害物质,维持肿瘤细胞的正常新陈代谢。因此,在肿瘤组织微环境中促血管生成因子和抗血管生成因子的动态平衡被打破(肿瘤细胞分泌大量促血管生成因子),朝着促血管生成的方向偏移,这种肿瘤组织内新生血管的产生机制被称为肿瘤的“血管生成作用(Tumor Angiogenesis)”
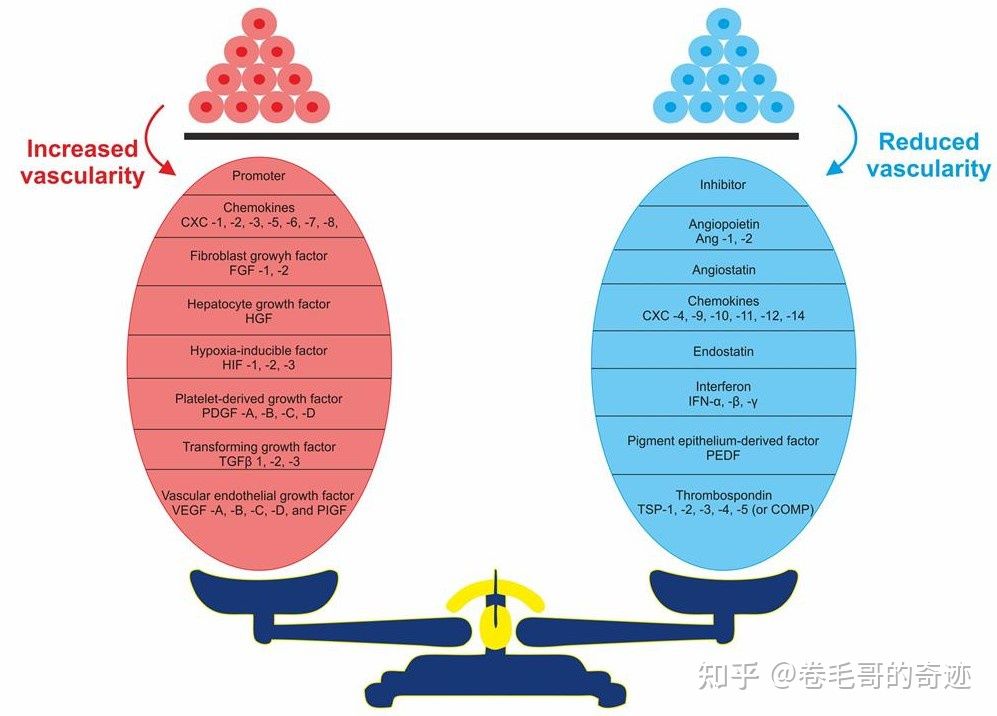
促血管生因子和抑制血管生成因子的动态均衡。左侧红色球内为促血管生成因子群,右侧蓝色球内为抑制血管生成因子群。
在肿瘤微环境中,肿瘤细胞为了满足其生存需求,大量分泌促血管生成因子,将血管生成作用的生理平衡打破,血管生成功能被激活,这一过程也被称为血管生成开关(angiogenic switch)的打开。在这种情况下血管生成作用通过两种机制完成新生血管的增殖,一种是通过上述的内皮细胞“出芽”机制完成增殖,第二种是通过内部增生(英文“intussusception”)机制来完成。

肿瘤组织血管生成的两种不同机制。在促血管生成因子(本图以VEGF为例)的诱导下,肿瘤组织中的血管通过A:出芽增殖,和B:intussusception的方式增殖。两种不同增殖方式的机制差异可能跟VEGF的浓度相关。
三、VEGF
VEGF是一种分子量大小为40-45kDa的促血管生成因子家族,英文全称Vascular Endothelial Growth Factors。VEGF在1983年被发现的,1989年VEGF蛋白首次被分离,且其在血管生成过程中的作用机制也被发现。
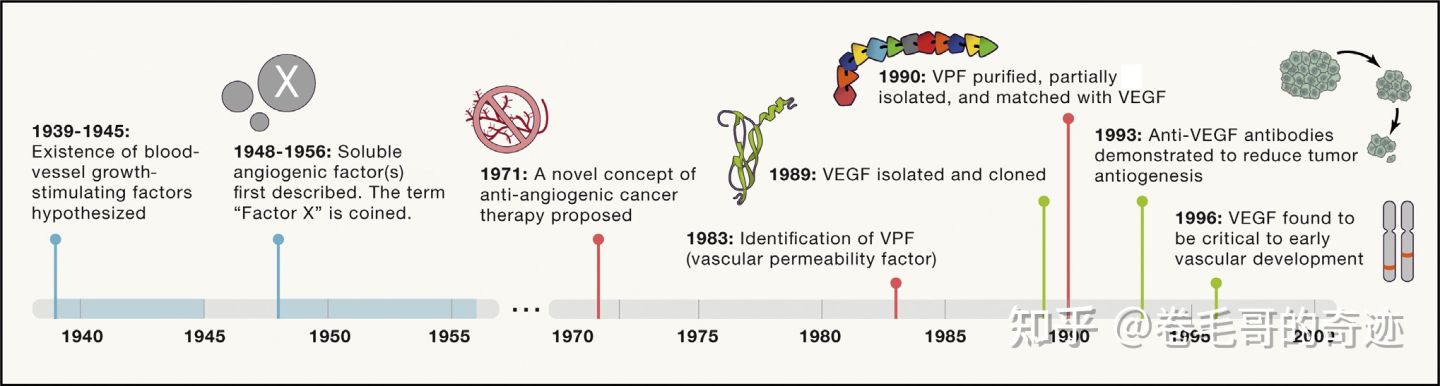
VEGF被发现的历史时间轴 VEGF蛋白的三级结构为两片反向平行的同二聚体(见下图),其家族的蛋白成员包括:VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和PlGF。其中VEGF-A在调节正常机体和疾病相关的血管生成机制中起到较为重要的作用。
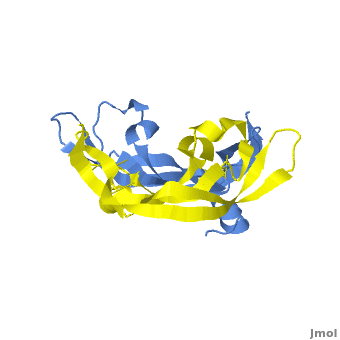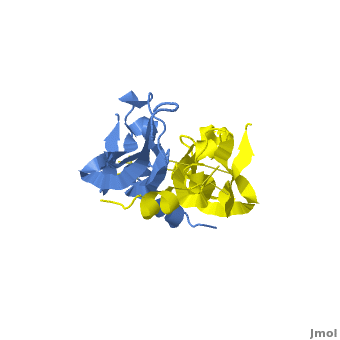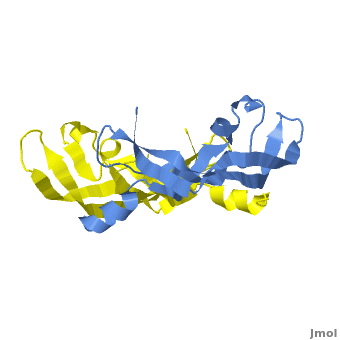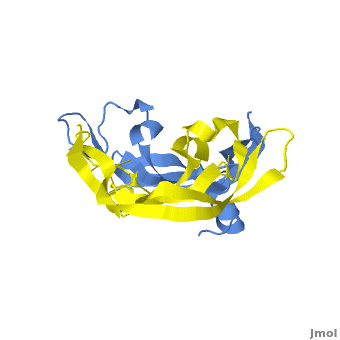
VEGF-A的三级结构示意图 编码VEGF-A的vegfa基因位于6号染色体短臂2区1带3亚带(6p21.3),长度约为28kb,包含8个外显子和7个内含子。vegfa基因可以编辑多个剪切异构体,这包含(以氨基酸长度为命名依据):VEGF121、VEGF145、VEGF162、VEGF165、VEGF183、VEGF189和VEGF206。不同的剪切异构体在不同的组织中的表达量不同,每一个剪切异构体都可以和不同的受体结合,这有利于满足不同组织对血管生成作用的不同生物学需求;其中VEGF121、VEGF165和VEGF189是最表达最广泛的剪接异构体。

VEGF-A各个剪切异构体在正常组织和肿瘤组织中的相对表达水平。三角形的三个端点分别代表VEGF121、VEGF165、和6号外显子表达的异构体家族(145/183/189)。圆形的小点代表肿瘤组织,正方形的小点代表正常组织,颜色相同的点代表来源相同的组织。表达量的检测是利用RT-PCR手段对细胞系、胚胎组织、成体组织以及肿瘤组织等生物样本中剪接异构体的mRNA的表达进行检测。
四、VEGF的受体:VEGFR
VEGF调节肿瘤的血管生成,主要通过和其受体(VEGFR1、VEGFR2和VEGFR3)结合,从而激活细胞内信号通路;
VEGF受体(VEGFR)的结构共有三个部分:细胞外的VEGF结合区,该区域由7个免疫球蛋白样结构构成;受体的跨膜区(TM);细胞内的信号传导结构域,包括酪氨酸激活结构。
VEGFR和VEGF蛋白结合后,其胞内信号转导区的酪氨酸随即发生磷酸化,从而激活细胞内信号通路,最终导致血管内皮细胞的生长、增殖和成熟,新生血管的生成。
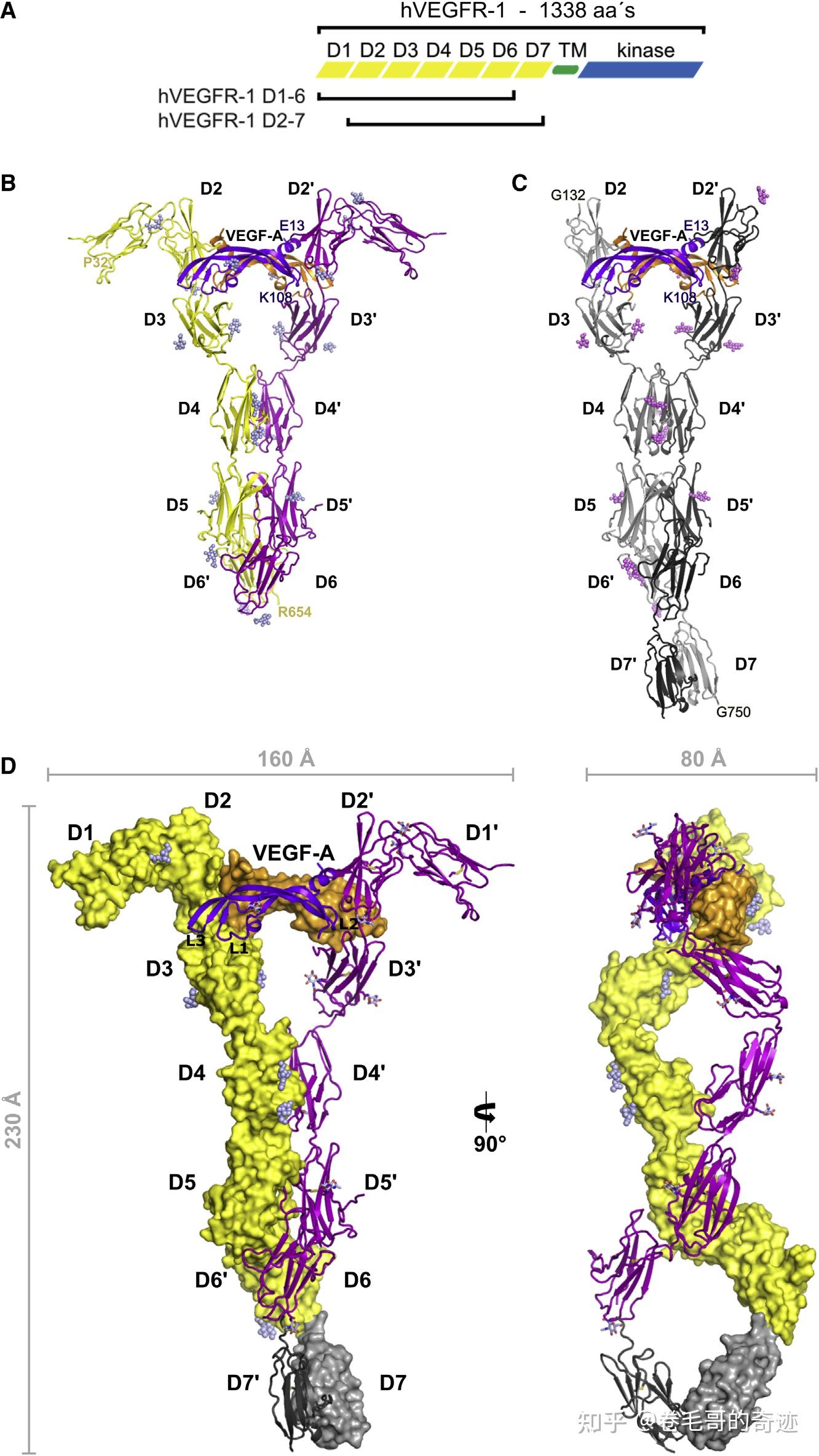
VEGF-A和VEGFR-1(胞外结构域)结合的三维结构。A:VEGFR蛋白序列的结构简图,黄、绿、蓝三色分别代表胞外区、跨膜区和胞内区;B:VEGF-A和VEGFR-1 D1-6结合的三维结构,其中紫色和橙色的为结合的VEGF-A二聚体;C:VEGF-A和VEGFR-1 D2-7结合的三维结构,其中紫色和橙色的为结合的VEGF-A二聚体;D:VEGF-A和VEGFR-1(胞外结构域)结合的三维结构。
VEGFR家族亦有三个成员,不同的成员在不同的组织中表达量有所不同,VEGFR1和VEGFR2主要在血管内皮细胞中表达,也会在巨噬细胞和肿瘤细胞中过表达;VEGFR3主要在内皮淋巴细胞中表达。另外,VEGFR家族,除了和VEGF蛋白结合外也可以和其他蛋白结合,例如:神经素、整联蛋白、钙黏蛋白等。
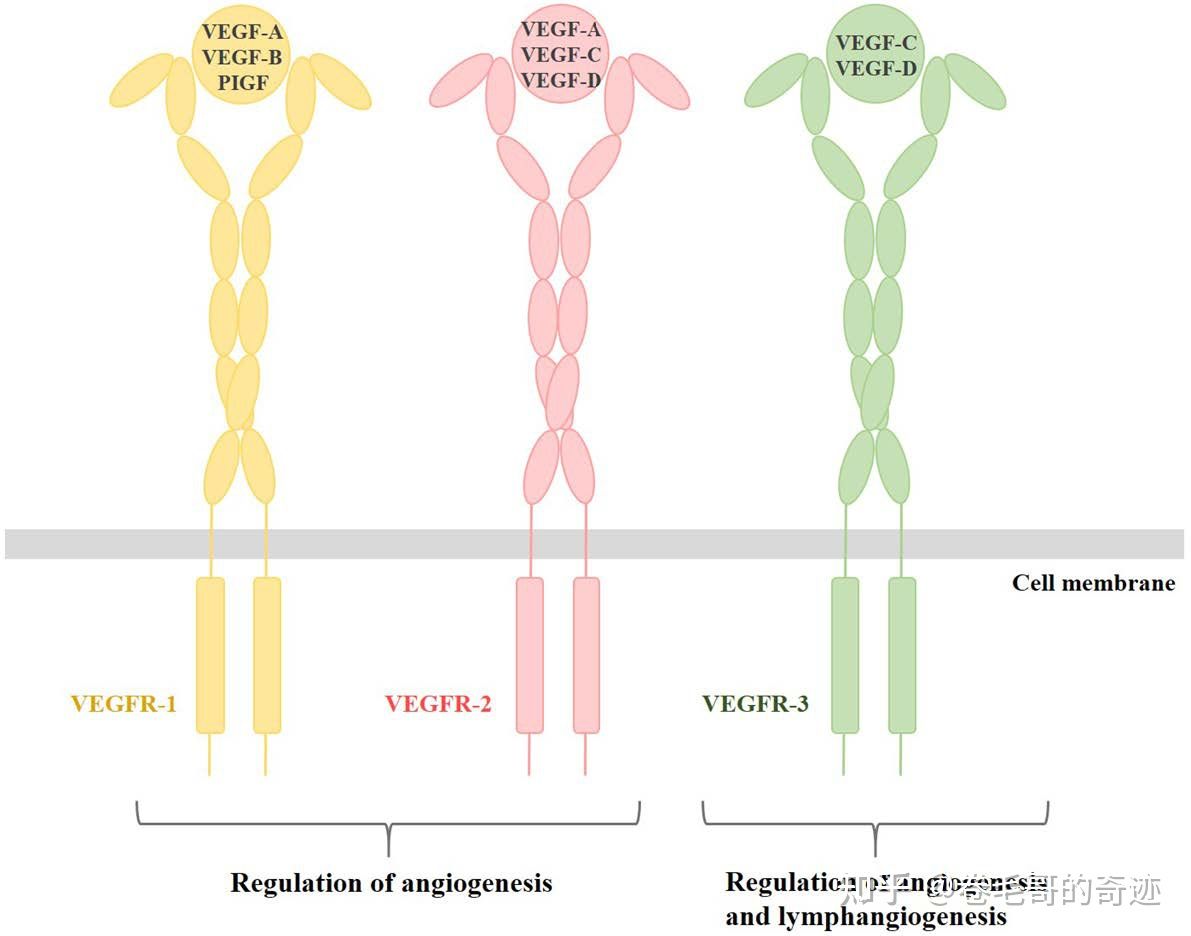
VEGF-VEGFR 信号系统简图。其中,VEGFR-1和VEGFR-2系统负责血管生成作用,而VEGFR-3则同时负责血管和淋巴管的生成作用。VEGF家族的不同成员也对应的和不同的受体家族的胞外结构域结合。
五、抗VEGF-VEGFR药物
抗VEGF-VEGFR药物大致包括以下几类:直接靶向VEGF和VEGFR蛋白的抗体药物,例如贝伐单抗和雷莫芦单抗;细胞内的酪氨酸激酶信号通路抑制剂,例如索拉菲尼等;另外还有融合蛋白以及免疫调节剂等类型的药物。

参考资料
- https://zhuanlan.zhihu.com/p/357547859
- Apte R S, Chen D S, Ferrara N. VEGF in signaling and disease: beyond discovery and development[J].Cell, 2019, 176(6): 1248-1264.
- De Palma M, Biziato D, Petrova T V. Microenvironmental regulation of tumour angiogenesis[J]. NatureReviews Cancer, 2017, 17(8): 457.
- Lopez A, Harada K, Vasilakopoulou M, et al. Targeting angiogenesis in colorectal carcinoma[J]. Drugs,2019, 79(1): 63-74.
- Lugano R, Ramachandran M, Dimberg A. Tumor angiogenesis: causes, consequences, challenges andopportunities[J]. Cellular and Molecular Life Sciences, 2020, 77(9): 1745-1770.
- Maj E , Papiernik D , Wietrzyk J . Antiangiogenic cancer treatment: The great discovery and greatercomplexity (Review)[J]. International Journal of Oncology, 2016.
- Melincovici C S, Bosca A B, Susman S, et al. Vascular endothelial growth factor (VEGF)-key factor innormal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59(2): 455-467.
- Park S A, Jeong M S, Ha K T, et al. Structure and function of vascular endothelial growth factor andits receptor system[J]. BMB reports, 2018, 51(2): 73.
- Markovic-Mueller S, Stuttfeld E, Asthana M, et al. Structure of the Full-length VEGFR-1 ExtracellularDomain in Complex with VEGF-A[J]. Structure, 2017, 25(2): 341-352.
- Peach C J, Mignone V W, Arruda M A, et al. Molecular pharmacology of VEGF-A isoforms: binding andsignalling at VEGFR2[J]. International journal of molecular sciences, 2018, 19(4): 1264.
- Rahma O E, Hodi F S. The intersection between tumor angiogenesis and immune suppression[J]. ClinicalCancer Research, 2019, 25(18): 5449-5457.
- Rajabi M, Mousa S A. The role of angiogenesis in cancer treatment[J]. Biomedicines, 2017, 5(2): 34.
- Saman H, Raza S S, Uddin S, et al. Inducing angiogenesis, a key step in cancer vascularization, andtreatment approaches[J]. Cancers, 2020, 12(5): 1172.
- Ribatti D, Vacca A. The role of microenvironment in tumor angiogenesis[J]. Genes & nutrition, 2008,3(1): 29-34.
- Sara, Sigismund, Daniele, et al. Emerging functions of the EGFR in cancer[J]. Molecular Oncology,2017.
- Sitohy B , Nagy J A , Dvorak H F . Anti-VEGF/VEGFR Therapy for Cancer: Reassessing the Target[J].Cancer Research, 2012, 72(8):1909.
- Stryker Z I, Rajabi M, Davis P J, et al. Evaluation of angiogenesis assays[J]. Biomedicines, 2019,7(2): 37.
- Taurone S, Galli F, Signore A, et al. VEGF in nuclear medicine: Clinical application in cancer andfuture perspectives (Review) Corrigendum in/10.3892/ijo. 2016.3636[J]. International journal of oncology, 2016, 49(2): 437-447.
- Uccelli A, Wolff T, Valente P, et al. Vascular endothelial growth factor biology for regenerativeangiogenesis[J]. Swiss medical weekly, 2019, 149(0304).
- Vempati P, Popel A S, Mac Gabhann F. Extracellular regulation of VEGF: isoforms, proteolysis, andvascular patterning[J]. Cytokine & growth factor reviews, 2014, 25(1): 1-19.
- Weis S M, Cheresh D A. Tumor angiogenesis: molecular pathways and therapeutic targets[J]. Naturemedicine, 2011, 17(11): 1359-1370.
- Yang J, Yan J, Liu B. Targeting VEGF/VEGFR to modulate antitumor immunity[J]. Frontiers inimmunology, 2018, 9: 978.
