【1.7.4.7】CD47(integrin-associated protein, IAP)
一、CD47靶点介绍
CD47又称为整合素相关蛋白(integrin-associated protein, IAP),属于免疫球蛋白超家族,是一个拥有5个跨膜域的跨膜糖蛋白,广泛表达于几乎所有的正常细胞表面。目前已知的CD47的天然配体有三种:
- 整合素(integrin)
- 血小板反应蛋白-1(Thrombospondin-1,TSP-1)
- 信号调节蛋白α(Signal-regulatory proteinα,Sirpα)。
CD47与其配体主要参与细胞黏附、细胞迁移、吞噬功能,以及维持机体免疫稳态。
其中,Sirpα的表达局限于巨噬细胞、树突状细胞以及神经细胞表面。在免疫反应中,CD47主要通过与巨噬细胞表面的Sirpα结合,释放一个“别吃我”信号,从而保证正常细胞不被巨噬细胞“吃掉”。在这里,CD47扮演了一个“自我(self)”细胞的标记,而一些肿瘤细胞也会利用CD47/Sirpα信号通路,高表达CD47以实现免疫逃逸。
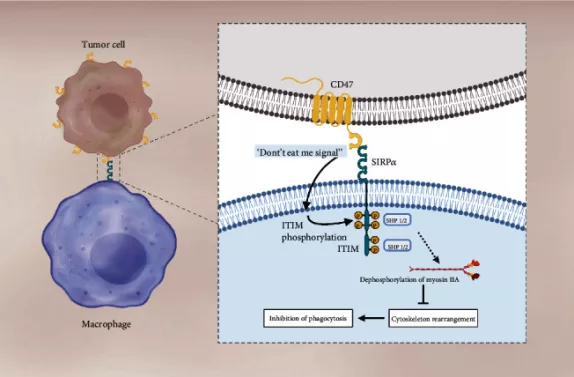
二、CD47靶点抑制剂的作用机制
针对CD47-SIRPα信号通路的疗法有多种作用机制,主要包括:
- 阻断CD47与SIRPα的结合,瓦解“别吃我”信号,促进吞噬细胞吞噬肿瘤细胞;
- CD47抗体可通过促进DC细胞对肿瘤细胞的吞噬作用,随后将抗原呈递给T细胞,刺激抗肿瘤适应性应答;
- CD47抗体通过NK细胞介导的ADCC和CDC作用杀伤肿瘤细胞;
- CD47抗体可激活肿瘤细胞凋亡途径,直接诱导肿瘤细胞凋亡。
三、CD47靶点适应症
CD47抗体可针对多种适应症,目前临床试验针对该靶点的适应症包括非霍奇金淋巴瘤(NHL)、急性髓性白血病(AML)等血液系统恶性肿瘤,以及结肠直肠癌、卵巢癌、乳腺癌、膀胱癌和头颈癌等实体瘤。从目前数据来看,CD47靶点在高风险骨髓增生异常综合征表现出优异响应,但在非霍奇金淋巴瘤初步响应并不高,实体瘤(如非小、胃癌、头颈癌)早期响应不理想,头颈癌和胃癌早期响应在20%左右。头颈癌适应症,ALX148联合帕博利珠单抗,总体响应20%;胃癌适应症,ALX148联合曲妥珠单抗,总体响应21%。
四、CD47全球在研管线
CD47抗体疗法主要分为三个研究方向:单药、联用治疗性抗体药物以及联用T细胞检查点抑制剂。目前,全球超过30家公司正在开发针对CD47靶点的药物,具体涉及单抗、双抗、融合蛋白和小分子三类,其中有近20款已迈入临床研究阶段,暂无该靶点药物上市,最高开发阶段为临床III期。国外有Forty Seven、Celgene、Trillium、ALXOncology等,而国内除了天境生物,目前也有不少药企拿到了临床批件,如信达生物、恒瑞医药、宜明昂科、再鼎医药等等。
图表. 全球CD47在研管线(资料来源:clinical trials)

五、CD47抗体开发的挑战
-
红细胞毒性:由于正常细胞(包括红细胞、T淋巴细胞等)也表达CD47,因此需要特别注意所开发的抗体是否会对正常细胞带来不利影响。如果抗体与红细胞结合,则可以通过两种途径引起红细胞破坏:一是通过抗体与不同红细胞结合而造成红细胞凝集,进而引起红细胞裂解;二是通过Fc介导的效应功能(ADCC/ADCP)引起NK/Mf细胞攻击红细胞。因此,如何避免与红细胞结合就成了CD47抗体药物开发的首要关注点。
-
T淋巴细胞毒性:如果CD47抗体与T淋巴细胞CD47的某个表位结合,就有可能引起T细胞凋亡,如果开发的抗体药碰巧引起了T淋巴细胞凋亡,那么临床开发就不可能成功。
-
IgG亚类的选择:CD47这个免疫检查点对应的免疫细胞是巨噬细胞,而激活这类细胞依赖于Fc-FcgR相互作用,仅仅阻断CD47-SIRPα相互作用是不足以激活巨噬细胞的,从这方面考虑,CD47抗体应该选择IgG1才能够激活巨噬细胞。然而由于CD47抗体多半能与红细胞结合(即使经过大量筛选,也很难排除与红细胞的结合,只能筛选结合相对较弱的抗体),如果选择IgG1,则会激活免疫细胞(Mf, NK)对红细胞进行攻击,所以为了避免由此而产生的红细胞毒性,只能选择IgG4,这样一来,抗肿瘤活性就大打折扣,单独用药的疗效十分有限,必须与其它具有ADCC/ADCP活性的抗体药联用才能达到预期效果。到目前为止,所有开发CD47抗体的公司,都选择了IgG4。
-
临床前动物模型:在评估早期CD47项目时,动物模型的选取非常关键。数据显示人类CD47和SirpαNOD模型SIRPα的结合亲和力是和人SIRPα结合的约10倍,因此数据很难复制到人体临床试验。并且SirpαNOD是免疫缺陷小鼠,无法还原诸如ADCC等重要机制。理想的异种移植模型应该是SIRPα对CD47的亲和力低于NOD,但高于C57BL/6,BALB/c可能是这样的候选者。
1. 靶点机制(图30)
CD47 又称整合素相关蛋白(integrin-associated protein,IAP),属于免疫球蛋白超家 族,是一种具有糖基化的跨膜蛋白,由胞外可变区、跨膜区和亲水羧基端胞内区构成,胞 外区可结合的配体有整合素、SIPRα 和 TSP1。配体中的 SIRPα 主要表达于巨噬细胞、树 突状细胞等细胞膜表面,二者结合后,通过传递“别吃我”的信号抑制巨噬细胞的吞噬作用。
CD47 可调控自身免疫和恶性肿瘤。在自身免疫疾病中,CD47 过度刺激免疫系统, 导致免疫系统攻击自身健康组织。而在恶性肿瘤中,CD47 则对免疫系统刺激不足,导致 肿瘤细胞逃避免疫系统杀伤,造成肿瘤免疫逃逸。在肿瘤细胞表面过表达的 CD47 可以帮 助这些细胞逃避免疫细胞的监视和清除,因此,CD47 成为抗肿瘤新药开发的一个极具吸 引力的靶标。
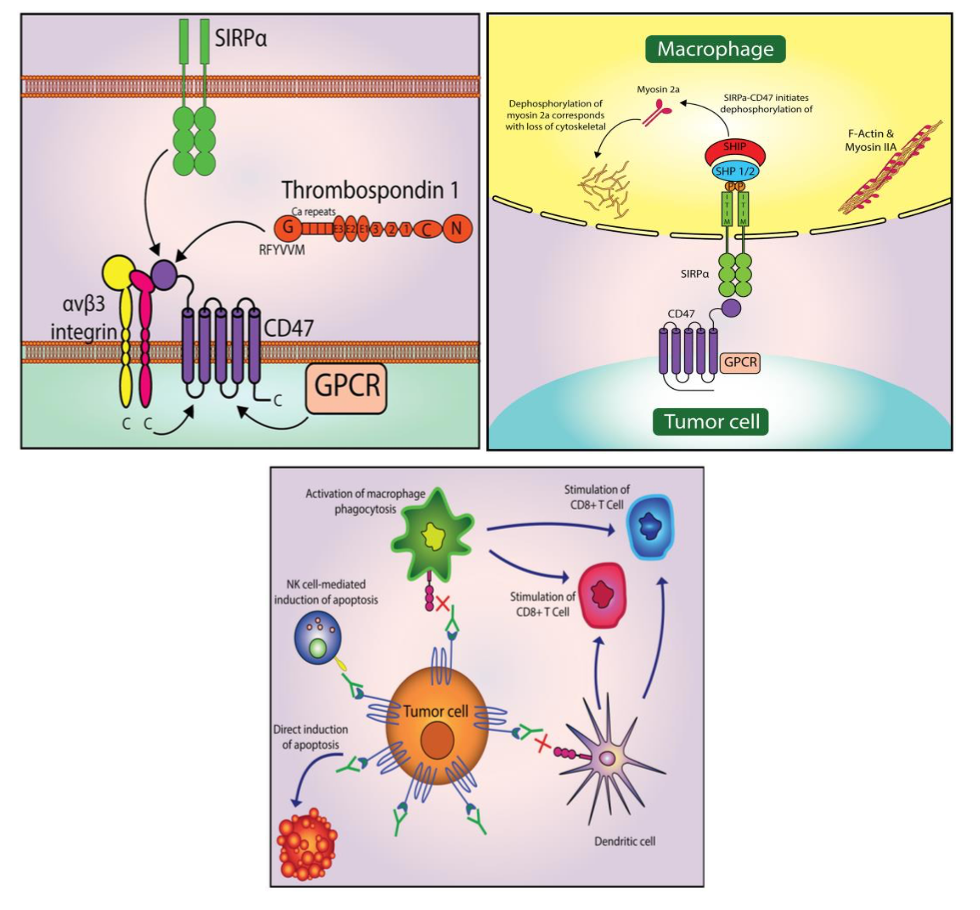
资料来源:Hayat SMG,Bianconi V,Pirro M,et al.CD47:role in the immune system and application to cancer therapy[J].Cell Oncol(Dordr),2020,43(1):19-30.doi:10.1007/s13402-019-00469-5.Epub 2019 Aug14. PMID: 31485984.
大量研究表明,CD47 在不同类型的肿瘤中过度表达,包括骨髓瘤、平滑肌肉瘤、急 性淋巴细胞白血病、非霍奇金淋巴瘤、乳腺癌、骨肉瘤、头颈部鳞癌,也见于部分肿瘤的 干细胞,并与不良预后相关。这些肿瘤细胞通过高表达 CD47,与肿瘤相关巨噬细胞(tumor- associated macrophage,TAM)表面 SIRPα 结合,激活“别吃我”信号,不仅逃避免疫系统 攻击,直接导致 TAM 不但与肿瘤细胞和谐共处,还可通过促进肿瘤内血管增生、抑制效 应 T 细胞等机制促进肿瘤细胞增殖和扩散。通过靶向 CD47 阻断该通路,恢复巨噬细胞的 吞噬作用,杀伤肿瘤细胞已经变成近些年的研究热点。另外,由于红细胞膜蛋白 CD47 可 以通过与巨噬细胞表面分子 SIRPα 相互作用抑制吞噬。当 CD47 单抗杀死肿瘤细胞时, 它们不可避免地引起红细胞凝集,继而引起红细胞裂解,贫血和血小板减少症已成为剂量 限制性毒性因素。同时,CD47 单抗药物在到达肿瘤细胞之前就可能会被红细胞耗尽。
虽然迄今全球范围内尚无CD47单抗获批上市,但据不完全统计,超过30家公司正在 开发针对CD47及其配体SIRPα的药物,包括单克隆抗体、双特异性抗体、融合蛋白和小分 子化合物等,其中10款以上已进入临床研究阶段,部分已进入临床研究II期阶段,如吉利 德公司于2020年3月收购CD47靶点先驱公司Forty Seven的Magrolimab。CD47单抗目前研 究进展较快,但严重贫血的不良反应需要重视,并需要进一步优化。2020年9月,艾伯维 公司与天境生物就CD47单克隆抗体Lemzoparlimab(TJC4)达成全球战略合作,通过差异 化设计,成功避免了严重贫血。2020年9月,Trillium Therapeutics的CD47单抗TTI-621,采 用IgG1亚型也可规避对红细胞的毒性。
2. 临床研究申报概况
目前,在中国针对 CD47 的抗肿瘤新药研发呈井喷式上涨,已成为后 PD-1 时代竞争 最为激烈的赛场之一。今年在此领域布局的中国药企已达 48 个之多,其中步伐较快的药 企已拥有 1 项III期临床试验,1 项II期临床试验;单个药企拥有项目数较多的目前已拥有 14 个新药在研,其中包括进入II期的有 1 项,I期的 2 项,另有 10 个尚处于临床前研究 及 1 个刚获批临床研究;紧随其后的分别是拥有 4 项临床前与 1 项I期及拥有 2 项临床前 的2家企业。总的说来,今年针对CD47的全球在研新药数目为144项,我国就有78项, 不仅在数量上有所提升,还在质的方面有所飞跃,其中进入III期临床试验的有 Letaplimab, 进入II期临床试验的有 6MW3211、HX-009、IBI322、莱法利单抗、Lemzoparlimab,处于 I/II期的有 IBC0966、JMT601。其余 70 项则均处于I期或临床前研究中。可见今年针对 CD47 的抗肿瘤新药热度有增无减,而我国新药研发已占据全球市场的半壁江山。
3. 简评
CD47 作为天然免疫重要的“免疫检查点”分子,对细胞的迁移、黏附、增殖和凋亡都 能发挥作用。靶向免疫检查点 CD47-SIRPα 的单一疗法和联合疗法具有独特的作用机制, 越来越多的新药已开展临床研究,但多数仍然徘徊在早期阶段。靶点 CD47 的赛道火热,引起群雄逐鹿,差异化竞争日趋明显。一方面显示该领域具有极大的治疗潜力,临床上对 新型、安全、有效的肿瘤免疫治疗药物和技术的需求强烈;另一方面也提示其临床疗效与 安全性尚处于确证和优化阶段,特别是严重贫血仍为该药物研发应用的巨大挑战。从初步 的I期临床研究的数据看,CD47 单抗不仅会引起严重贫血,还对整体骨髓造血功能都有较 强烈的抑制作用。因此,其临床价值只有在骨髓造血系统与肿瘤组织之间的 CD47 分子差 异化分析解决之后才能得到体现。
参考资料
- https://mp.weixin.qq.com/s/2NeYuxo5ULTnGn8cPF1nEA
- 2022年度中国抗肿瘤新药临床研究评述
