【3.4.5】盐桥(salt bridges)
在化学中,盐桥是两种非共价相互作用的组合:氢键和静电相互作用(hydrogen bonding and electrostatic interactions)(图1)。 最通常观察到这有助于蛋白质的熵不利折叠构象的稳定性。 尽管已知非共价相互作用是相对弱的相互作用,但小的稳定相互作用可以加在一起,对构象异构体的整体稳定性起重要作用。[1] 不仅在蛋白质中发现了盐桥,而且还可以在超分子化学( supramolecular chemistry )中发现它们。 通过实验程序探索每种热力学,以评估盐桥对状态总自由能的自由能贡献。
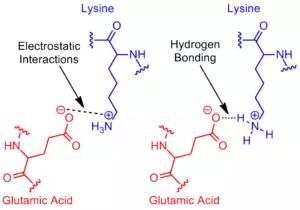
盐桥最常来自天冬氨酸或谷氨酸的阴离子羧酸盐(RCOO-)和精氨酸的赖氨酸或胍盐(RNHC(NH2)2+)的阳离子铵(RNH3 +)(图2)。[1 ] 尽管这些是最常见的,但取决于干扰其pKa的外部因素,其他具有可电离侧链的残基(例如组氨酸,酪氨酸和丝氨酸)也可以参与。 参与盐桥的残基之间的距离也被认为是重要的。 所需距离小于4Å(400 pm)。 大于此距离的氨基酸不构成盐桥。[3] 由于在整个蛋白质中发现了许多可离子化的氨基酸侧链,因此放置蛋白质的pH值对其稳定性至关重要。
蛋白质中的盐桥是带相反电荷的残基之间的键,这些残基彼此之间非常接近,可以经受静电吸引。它们有助于蛋白质结构以及蛋白质与其他生物分子相互作用的特异性,但这样做并不一定需要增加蛋白质的自由折叠能。
盐桥的净静电自由能可分为三个部分:
- 电荷-电荷相互作用(charge-charge interactions)
- 电荷与永久偶极子的相互作用(interactions of charges with permanent dipoles)
- 电荷的去溶剂化(desolvation of charges)
能量上有利的库仑电荷-电荷相互作用通常与相互作用电荷的不利去溶剂作用相反。结果,盐桥可能使折叠的蛋白质的结构不稳定。
有两种方法可以通过实验估算盐桥的自由能贡献:pK(a)方法和突变方法。
- 在pK(a)方法中,电荷由蛋白质折叠时静电相互作用的变化引起的可电离基团的pK(a)的变化获得,从而使电荷对蛋白质的解离自由能有所贡献。 pK(a)方法提供了可电离基团带电时获得或损失的相对自由能。
- 在突变方法中,相互作用电荷之间的耦合自由能是从双重突变循环中获得的。耦合自由能是电荷-电荷相互作用自由能的间接和近似度量。
- pK(a)方法和突变方法都不能提供盐桥的净自由能。当前,这只能通过计算方法来获得,但是由于简化的假设以及计算所基于的结构信息不足,因此往往容易产生较大的不确定性。这种情况使盐桥能量的精确热力学定量变得非常困难
其他有用的信息
根据Gilli等人提出的氢键分类(下图), 盐桥对应于双电荷辅助氢键 ((±)CAHB), 它被定义为一个酸和一个碱形成的键, 其供体-受体pKa接近匹配. 因此, 盐桥是两个电离分子之间的非共价作用, 混合了多个能量贡献.
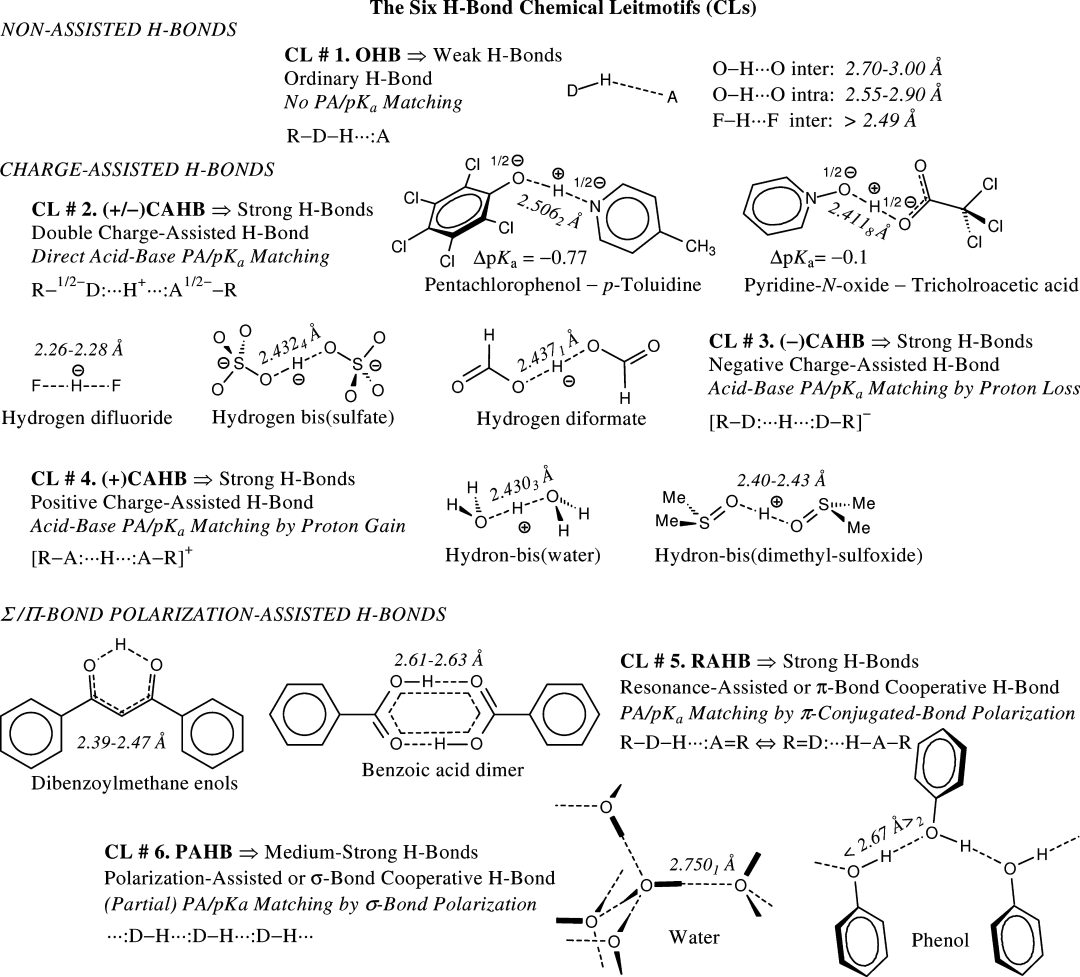
根据Van Der Lubbe等人, 以下几个能量组成成分都可能对氢键的能量有贡献,包括:
- 静电相互作用,
- 电荷转移相互作用,
- π共振协助,
- 立体排斥,
- 合作效应,
- 分散相互作用和
- 次级静电相互作用.

关于电荷辅助的氢键, 在过去的二十年里,有很多人用理论和实验方法进行了研究。例如O’Meara等人在Rosetta程序中把显性的氢键势与依赖距离的库仑静电模型结合起来, 在各种基准数据集上都显示了更好的性能, 包括诱饵识别、侧链预测和蛋白质设计模拟中的原生序列恢复. 许多研究也涉及到盐桥对蛋白质构象稳定性的贡献.
Kurczab等人则对蛋白-配体复合物体系中的盐桥做了全面分析, 考察盐桥在生物相关和模型系统中的性质和意义. 他们对PDB, DrugBank和GPCRdb这些对药物设计有意义的数据库进行了分析, 并通过使用几个盐桥模型系统的高性能量子化学计算来支持统计学分析.
下图显示了他们从DrugBank (蓝色) 和PDB (绿色) 中发现的小分子结构中提取的可能作为盐桥受体或供体的最常见官能团的百分比.
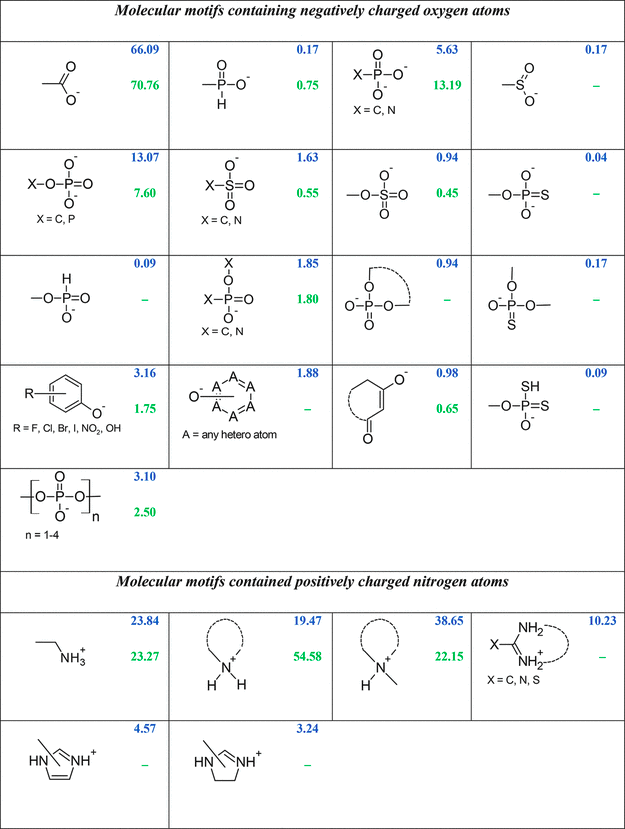
如图, 在DrugBank中最常见的带负电的分子片段是羧基 (约占所有带负电的药物分子的66%, 占所有药物的16%), 其次是有机磷家族, 主要包括磷酸酯、膦酸盐和多磷酸盐, 以及以单硫磷酸盐和双硫磷酸盐为代表的其硫磺类似物 (有机硫磷酸盐). 对于拥有正电荷氮原子的药物分子, 聚类结果显示, 叔胺类 (包括脂肪族和环状) 是占多数的一类 (约占所有确定的正电荷药物分子的39%, 约占所有药物的10%), 而伯胺和仲胺的分布水平相似, 分别约为24%和20%.
对于距离和角度的分布,以及盐桥的能量, 他们也通过使用模型系统的高性能量子化学计算来支持统计分析. 然而这样独立体系的能量研究对药物设计来说意义不是很大. 有电荷辅助的蛋白-配体氢键作用对结合的贡献关键取决于蛋白质的环境.
虽然盐桥的氢键距离比中性基团之间的氢键距离短, 表明相互作用更强, 但这并不一定转化为更有利的结合自由能. 对于暴露于溶剂中的盐桥的理论和实验研究显示, 单价离子配对的自由能增益很小. 在复合物的结合部位形成电荷辅助的氢键导致亲和力明显改善的例子非常少. 这可以用暴露在溶剂中的带电蛋白残基的高溶解自由能需要通过配体结合补偿来合理解释.
不过也存在一些SAR的例子, 其中盐桥是关键的结合热点. 这些例子大部分的共同点是, 相互作用的蛋白质基序至少部分被埋藏起来, 并通过与周围残基的其他相互作用保持在一定位置. 一个教科书式的例子是胰蛋白酶类丝氨酸蛋白酶的S1口袋底部的Asp189与苯甲脒抑制剂之间的关键盐桥,在那里去除脒基或减少碱性会强烈降低活性.

另外, 在tRNA-鸟嘌呤转糖酶配体的lin-benzoguanine中引入一个2-氨基会导致Ki降低50倍. 修饰后的配体和部分蛋白质骨架和一个更远的谷氨酸侧链形成一个协同的电荷辅助氢键网络 (PDB 2Z7K).

另外一个例子是, 在一系列与神经氨酸酶结合的扎那米韦类似物中,带正电荷的氨基比中性的羟基取代基的活性大约高30倍. 这个取代基连接了两个带有负电的Glu和Asp侧链, 提供了额外的静电稳定 (PDB 1BJI). 由于带电相互作用的长程特性,在设计电荷辅助氢键时, 不仅要考虑蛋白质与配体的直接接触, 还要考虑更远的蛋白质电荷的影响.

最后一个例子是一系列强效凝血酶抑制剂, 通过简单地添加铵基作为氢键受体, 导致结合亲和力显著增加 (>500倍) (PDB 2ZC9). 不过这里添加的氨基没有形成盐桥, 而是和Gly216的骨架羰基形成了按照Gilli等人的氢键分类的正电荷辅助氢键 ((+)CAHB).

讨论
盐桥和氢键有啥区别? 怎么进行区分,怎么判断形成了盐桥,而不是氢键呢?
参考资料
- J Mol Recognit . Jan-Feb 2004;17(1):1-16. doi: 10.1002/jmr.657. Protein stabilization by salt bridges: concepts, experimental approaches and clarification of some misunderstandings .https://doi.org/10.1002/jmr.657
- https://encyclopedia.thefreedictionary.com/Salt+bridge+(protein)
- https://mp.weixin.qq.com/s/RQR2Z4v2sPF45BBfFRTIPg
