【6.7.1】CRISPR/Cas9介导的基因组工程中的脱靶效应
摘要:
CRISPR / Cas9是一种通用的基因组编辑技术,被广泛用于研究遗传元件的功能,创建转基因生物以及对遗传疾病进行临床前研究。 但是,脱靶活性(≥50%)的高频率,RGEN(RNA引导的核酸内切酶,诱导的突变不在预期的靶位上是一个主要问题,尤其是对于治疗和临床应用而言。 在这里,我们回顾了CRISPR / Cas9系统中脱靶切割的基本机制,检测脱靶突变的方法以及最小化脱靶切割的策略。 CRISPR / Cas9系统中脱靶特异性的提高将提供可靠的基因型-表型相关性,从而能够忠实地解释基因组编辑数据,这无疑将促进该技术的基础和临床应用。
在各种细菌和古细菌物种中发现的CRISPR(簇状,规则间隔,短回文重复序列)/ Cas9系统已成功用于编辑真核基因组1,2。现在在动物等不同领域也具有广阔的前景,疾病建模,材料科学,转基因植物技术,生物燃料技术,基因治疗和药物开发。 此外,CRISPR / Cas9技术极大地促进了在系统水平上对基因组功能组织的理解,从而有助于在遗传变异与生物表型之间建立牢固的因果联系.3,4,5,6然而,脱靶突变 在将CRISPR / Cas9系统应用于生物医学和临床应用时,仍然存在的主要问题是在高于预期突变的频率下观察到的突变可能会导致基因组不稳定并破坏其他正常基因的功能,这仍然是一个主要问题
一、Crispr / Cas9系统中脱靶效应的机制
CRISPR / Cas9系统充当细菌和古细菌中基于RNA的适应性免疫系统。II型CRISPR系统(包括CRISPR相关核酸酶9(Cas9))来自化脓性链球菌。天然CRISPR系统通过将病毒DNA的短重复序列掺入细菌基因组中来赋予对病毒的抗性。当细菌菌落第二次被感染时,这些重复的转录物会将核酸酶引导到入侵病毒的互补DNA上,从而破坏病毒DNA。为了使其在真核细胞中具有基因靶向能力,CRISPR 可以使用以下三个最小的成分在哺乳动物细胞中重建Cas9系统:Cas9,确定特异性的CRISPR RNA(crRNA,specificity-determining CRISPR RNA)和辅助反式激活RNA(tracrRNA)。crRNA和tracrRNA双链体也可以融合产生嵌合单向导RNA(sgRNA)。 sgRNA的前20个核苷酸与目标DNA序列互补,随后是称为原间隔子相邻基序(PAM)的序列,通常为NGG
尽管认为Cas9的靶向特异性受sgRNA的20-nt引导序列以及基因组中与靶序列相邻的PAM的存在严格控制,但在DNA序列上仍可能发生脱靶的切割活性,甚至在sgRNA指导序列的PAM远端部分中三到五个碱基对错配。此外,先前的研究表明,不同的指导RNA结构可以影响对靶和对靶的切割 -目标位点。晶体结构研究和单分子DNA幕帘实验表明,虽然PAM位点对于启动Cas9结合是必不可少的,但对应于crRNA互补识别序列3’端的种子序列与PAM直接相邻, 对于随后的Cas9结合,R环形成以及Cas9中核酸酶活性的激活也至关重要
二、sgRNA
SgRNA包含种子序列( seed sequence )和非种子序列(图1)。几项初步研究表明,与PAM相邻的10–12个碱基对(向导RNA的3’末端)被称为“种子序列”,可确定Cas9的特异性,并且通常比其余的向导RNA序列更为重要。 但是,染色质免疫沉淀后,对鼠胚胎干细胞中与催化死亡的Cas9(dCas9)结合的DNA进行测序(ChIP-seq),表明免疫沉淀的DNA中只有一到五个碱基对与引导区相匹配,这表明靠近PAM的1至5个碱基对的引导区标记为真正的“种子区”。Yu Zhang和他的同事在用CRISPR / Cas922靶向后,通过对人类基因组的ChIP-seq分析也证实了这些结果,并且与先前的观察结果一致,即邻近PAM的碱基配对对于DNA靶向至关重要。然而,用于检测dCas9靶位点的ChIP-seq分析仅捕获PAM的近端结合事件,而不捕获切割事件,导致对目标外站点的过度预测。 Pelletier和他的同事报告说,PAM远端序列可能触发Cas9的构象变化,参与CRISPR / Cas9 DNA靶标裂解,因此使用同样重视种子序列的sgRNA, PAM远端靶标序列会降低-目标编辑与仅使用种子区域的ChIP-seq数据进行比较。该结果可被视为对Sharp和同事通过ChIP-seq在小鼠胚胎干细胞中通过ChIP-seq在dCas9研究的全基因组结合图中报告的内容的补充。 ,他们已经揭示了明确的种子区域用于靶标结合和非常丰富的脱靶结合位点,但是,其中大多数都没有被Cas9实质性切割

种子序列通过多种潜在机制影响Cas9-sgRNA结合的特异性。种子区的序列决定基因组中“种子+ NGG”的频率,并控制Cas9-sgRNA复合物的有效浓度(Cas9结合或sgRNA的丰度和特异性)。同时,富含U的种子可能会导致sgRNA丰度降低和特异性提高,因为序列中的多个U可以诱导sgRNA转录终止。通常,在sgRNA的5’端,一到五个碱基对的错配比对它们的耐受性更好。在3’端,单个和双重错配的耐受程度取决于它们在引导RNA-DNA界面上的位置。还据报道,具有极低GC含量的sgRNA的活性往往较低。In Ren等人对果蝇中CRISPR / Cas9介导的诱变的研究。观察到诱变效率与sgRNA的PAM序列最接近区域的GC含量之间呈正相关,这是基于他们的证据,即最接近PAM序列的六个碱基对的序列中具有至少四个GC的sgRNA具有超过60%的可遗传突变(这意味着CRISPR / Cas9系统的有效sgRNA从父母那里产生的突变能够传给下一代),这表明可以根据近端序列的GC含量选择有效的sgRNA到PAM。当选择适当的因组序列,鸟嘌呤强烈优选和胞嘧啶强烈不利,因为紧邻PAM种子序列的第一个碱基。相反,在靠近PAM的第5个碱基的第5位,优选胞嘧啶而不是鸟嘌呤。腺嘌呤在sgRNA的中间位置受青睐,而胞嘧啶在18位不受欢迎(图1)。这些设计原则可能基于以下理论:富含鸟嘌呤的序列可以折叠成稳定的非规范结构,称为G-quadruplexes ,然而,在许多情况下,这种基本偏好在很大程度上取决于靶位点[10],tracrRNA的尾部序列对于体内Cas9的活性也非常关键。
三、PAM
PAM的序列也影响sgRNA的活性(图1)。初步结果表明,NGG(N为A,T,C或G)是PAM的规范序列。然而,最近的研究表明,II型CRISPR系统也可以使用NRG(图1)(其中R为G或A)作为PAM序列,尽管其结合效率仅为NGG的五分之一。几项研究报道,NRG序列是人类EMX基因座上CRISPR / Cas9介导的DNA切割的主要非规范PAM。PAM序列中每个碱基的结合频率是不同的。第一个核苷酸保守性最低,G的结合位点接近50%,而第二个核苷酸的G的结合位点> 90%,提示NRG不是设计CRISPR / RNA的最佳PAM。 因此,目前尚不清楚NRG PAM序列对Cas9 DNA切割的确切作用。
当通过通用的CRISPR / Cas9设计工具(表1)设计与目标DNA位点相对应的sgRNA时,每个sgRNA都有自己的PAM,通常为NGG。然而,实际上,如果我们想要在基因组中实现精确的插入或精确的点突变,则可能不存在对应于有效sgRNA的NGG,因此NRG(R = G或A)序列可被视为替代序列,尽管该序列较低,在NGG和NRG(R = G或A)均无法提供优化的sgRNA设计的情况下,可以选择另一种CRISPR / Cas9系统(Cas9直向同源物,嗜热链球菌Cas9和葡萄球菌Cas9)。将这些Cas9直向同源物用于基因编辑时,与野生型SpCas9相比,可以考虑NGA,NAC(图2)而不会引起更高的脱靶效应。

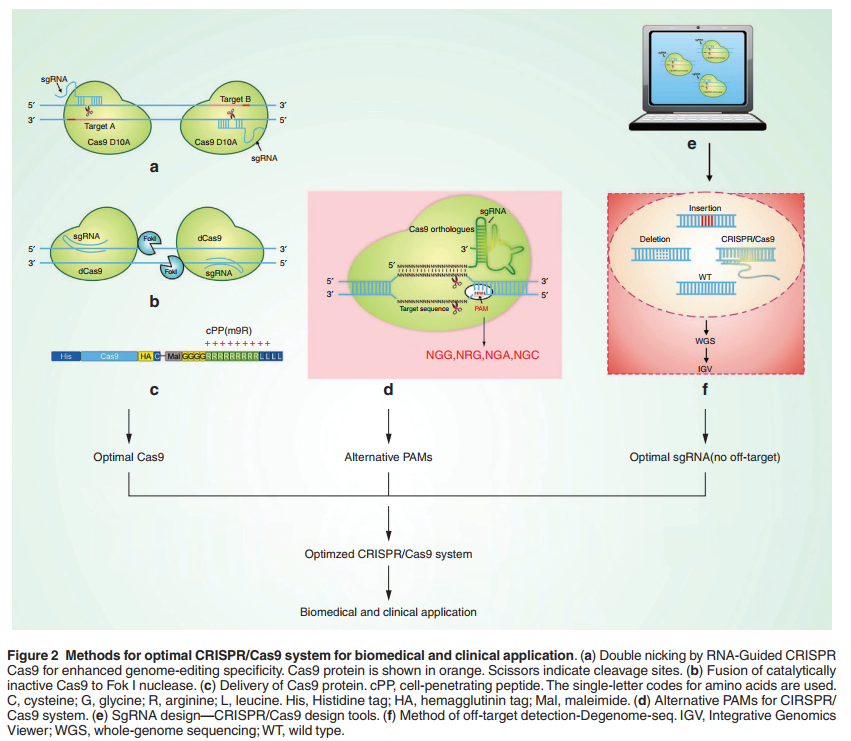
四、Cas9蛋白和其他因素
据报道,与编码Cas9和sgRNA的质粒序列的传递相比,将纯化的Cas9蛋白和sgRNA直接传递到细胞中会导致脱靶效应降低,因为Cas9-sgRNA核糖蛋白复合物几乎在传递后立即裂解染色体DNA,并在细胞中迅速降解。
脱靶效应可能是细胞类型特异性的,并且高度取决于特定细胞类型的双链断裂(DSB)修复途径的完整性。例如,核酸酶脱靶效应可能发生在转化失调的转化人类细胞系中DSBs修复途径,而具有相对完整的DSBs修复能力的健康人多能干细胞克隆的全基因组测序显示,几乎没有归因于核酸酶的脱靶突变。此外,据报道,CpG上的DNA甲基化这些位点可能会阻碍Cas9在细胞中的结合效率,而小分子通过同源性直接修复促进精确的基因组编辑来增强CRISPR基因组编辑(例如,L755507,一种73-肾上腺素受体激动剂,以及布雷菲德菌素A,一种细胞内蛋白抑制剂)。通过非同源末端连接(NHEJ)(例如叠氮胸苷或三氟吡啶)从ER转运到高尔基体)或序列特异性基因敲除。此外,朝着利用CRISPR / Cas9实现更有效的基因组编辑的目标,通过采用表观遗传学,DSB修复途径调节剂(例如小分子或RNAi策略)进行更具探索性的研究。可以通过同源性指导的修复或NHEJ进一步增强或抑制Cas9的特定基因组编辑途径,需要更广泛地研究。
总之,种子序列和PAM是CRISPR / Cas9必不可少的组成部分,需要仔细设计。此外,应在个别应用中考虑应用纯化的Cas9蛋白以及DSBs途径的调节性小分子,它们同时影响靶上效率和靶外特异性。
五、脱靶检测方法
以高度灵敏和全面的方式检测脱靶位点仍然是基因编辑领域的一项关键挑战。
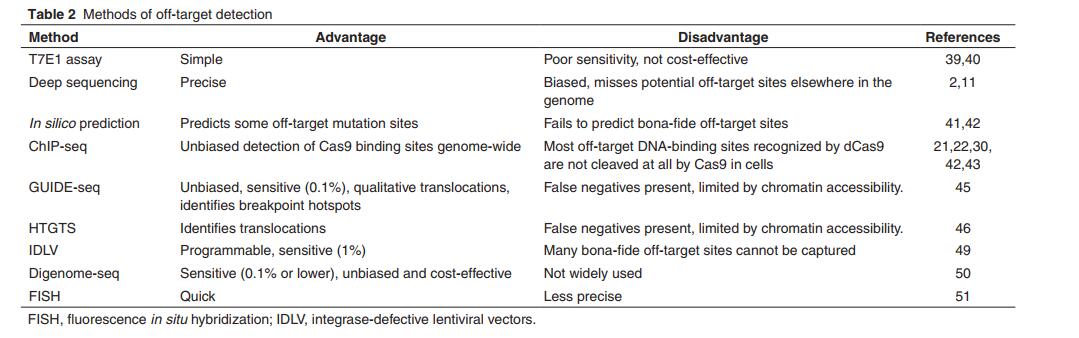
- T7核酸内切酶I检测法最初用于检测脱靶突变,但这种检测方法灵敏度低(无法检测目标突变发生在<1%的频率上),对于大规模筛查既不实际,也不具有成本效益。
- 多种先进的脱靶检测方法,包括深度测序(在频率范围内测量脱靶突变)从0.01%到0.1%),基于Web的预测工具和ChIP-seq的开发和广泛应用(表1)。
- 基于Web的算法具有先天的局限性,因为这些工具假定关闭-靶序列与靶上位点密切相关,其可能错过序列相似性较小的有害脱靶位点。
- ChIP-seq也已用于鉴定与催化失活的Cas9(dCas9)复合的sgRNA的脱靶结合位点。令人鼓舞的是,大多数已发表的著作表明,很少的脱靶切割位点是由活性Cas9核酸酶引起的。
最近报道了基于测序的全基因组无偏性鉴定(GUIDE-seq),基于对RNA引导的内切核酸酶(RGEN)引入的DSB的全球捕获,可以通过CRISPR实现脱靶切割的全基因组分析-Cas核酸酶。GUIDE-seq包含两个阶段。首先,在活体人类细胞基因组中,由RGEN诱导的DSB通过与NHEJ一致的末端连接过程在这些断裂处整合一个平直的34 bp双链寡聚脱氧核苷酸进行标记。其次,使用无偏扩增和下一代测序技术,可将基因组DNA中的dsODN整合位点精确定位在核苷酸水平上。该方法将脱靶诱变频率的检测范围扩展至低至0.12%,远远超出了现有的计算方法或ChIP-seq。值得注意的是,某些sgRNA可能诱导极低的频率,或者可能不会诱导不期望的突变(也许超出了GUIDE-seq技术的检测范围)。另一种新开发的,高通量,全基因组的易位测序(HTGTS)方法,可识别酵母I-SceImega核酸酶产生的“诱饵” DSB在靶位点的易位,并引入小鼠细胞的基因组中,转移至其他“猎物”细胞DSB全基因组。这种HTGTS方法不仅揭示了某些先前表征的核酸酶引起的脱靶位点多10倍,而且还提供了核苷酸水平的连接分辨率。该方法通过鉴定同源位点之间的易位进一步改善了脱靶位点的检测。染色体,这是先前未发现的不良附带效应。此处概述的策略可以用作严格的临床前途径的一部分,以客观地评估提议用于治疗用途的任何RGEN的潜在脱靶作用,从而从根本上改善最终将这些试剂翻译至临床的前景。
尽管使用了计算机和体外方法来筛选潜在的脱靶位点,但它们无法准确预测体内发生的突变。因此,检测体内脱靶突变发生位置的有效方法需要探索。 NHEJ优先将线性双链整合酶缺陷型慢病毒载体(IDLV)整合到DNA DSB中,从而可以在体内标记核酸酶生成的DSB,并且已被常规用于检测锌指核酸酶的脱靶切割位点。 当使用CRISPR / Cas9和转录激活因子样效应核酸酶(TALEN)系统靶向Wiskott-Aldrich综合征(WAS)时,一种经过改进的IDLV系统能够以低至1%的频率识别脱靶切割位点。和酪氨酸氨基转移酶(TAT)基因。因此,该方法可以作为替代工具来验证CRISPR / Cas9和其他基因编辑技术在临床前应用中的靶标特异性。
尽管已经显示出各种方法来揭示脱靶突变的频率在几个位点上至少一个数量级,但是仍然不清楚这些RGEN变体在整个基因组中是否没有脱靶效应。最近,体外Cas9消化的全基因组测序Digenome-seq已成为一种在人类细胞中分析可编程核酸酶(包括Cas9)的全基因组脱靶效应的可靠,灵敏,无偏且具有成本效益的方法。 Digenome-seq还包括两个阶段的过程。
- 首先,从没有RGEN的转染细胞和带有RGEN的转染细胞中分离完整的基因组DNA。然后将从RGEN转染中分离的DNA用或不用RGEN体外消化,将RGEN转染的细胞用RGEN体外消化,然后再进行全基因组测序。
- 其次,这些消化物可产生许多具有相同5’末端的DNA片段,从而产生在切割位点垂直排列的序列读数。相反,所有其他序列读段将以交错方式进行比对。在将序列读图映射到参考基因组后,作者使用整合基因组学查看器(IGV)观察了靶上和靶外位点的序列比对模式。
这种方法证明,Cas9靶外效应可以是通过用ggX20 sgRNA(“ g”和“ G”分别代表不匹配的鸟嘌呤和匹配的鸟嘌呤)替换“混杂”的sgRNA gX19或GX19 sgRNA来避免,从而提高了基因和细胞治疗应用的靶标特异性。此外,靶标外可以通过Digenome-seq仔细监测dCas9-FokI,成对的Cas9切口酶或其他可编程核酸酶的作用,以避免不必要的突变。当然,使用Digenome-seq在体内进行动物实验的验证还需要进一步研究。尽管不同的脱靶检测方法具有各自的特色优势(表2),但Digenome-seq目前被认为是验证下一代基因组编辑工具特异性的金标准。
脱靶评估可能既耗时又昂贵,尤其是对于简单的体外项目而言。然而,文献中的一些报告表明,与体内动物实验相比,体外细胞实验中脱靶突变的频率更高。在进行体外细胞实验时,可以根据特定实验的要求,选择表2中列出的无偏方法来进行脱靶检测,以揭示潜在的脱靶部位,这可能会混淆对实验结果的解释。也可以使用基于荧光原位杂交(FISH)的脱靶鉴定方法,该方法快速但精确度较低。有趣的是,在动物实验中,对于许多由CRIPSR /迄今为止,尚未报道Cas9包括小鼠,猪,猴子的脱靶突变,在已知的脱靶位点均未检测到损伤。有几种可能性可以解释在动物中没有报道的脱靶裂解。
- 首先,可以通过注射Cas9 mRNA或蛋白质来控制Cas9蛋白质的表达水平,其不仅比质粒转染快得多,而且降解迅速。
- 其次,研究人员倾向于使创始人的动物保持正确的目标突变,而不保持没有目标突变的动物,从而导致目标动物的变异偏离了一代又一代,即使创始人(F0)可能存在脱靶突变。此外,脱靶位点可能位于非编码区,因此,产生脱靶表型的可能性很小。
- 第三,在大多数已发表的动物模型研究中,用于检测脱靶裂解的方法和实验并非以全基因组,高分辨率和无偏见的方式进行,这可能掩盖了一些低频脱靶编辑位点。因此,应在动物水平上对脱靶卵裂位点进行更全面,更严格的检查,以备将来研究之用。
六、最小化脱靶效应的策略
已经报道了各种减少RGEN脱靶效应的策略。首先,可以改变sgRNA序列。截短sgRNA 3’末端(源自与Cas9相互作用的tracrRNA域),使与sgRNA 5’末端靶位点互补的区域缩短3 nt(tru-gRNA)或增加两个sgRNA 5’端的鸟嘌呤核苷酸(恰好在20-nt互补区之前)提高了靶标特异性,使某些脱靶位点的不希望的诱变减少了5,000倍。同时,使用这些改变的sgRNA的RGENs也降低了目标活动。修饰sgRNA序列以增强sgRNA的特异性而不损害目标效率的努力并未提供一致的结果。此外,据报道染色质可及性是体内结合的一个主要决定因素。正如Zhang和Sharp最近报道的那样,基因组中有数十万个“种子+ NGG”位点,但实际上只有不到1%的位点被dCas9结合,而大多数匹配都存在于启动子,增强子和基因中。因此,当我们在设计sgRNA时,应在启动子,增强子和基因中尽可能选择sgRNA,以提高靶标切割效率。但是,被CRISPR / Cas9系统切割的位点既可以是靶上位点,也可以是靶外位点,我们需要根据不同的实验目的进行平衡。
第二,一种最小化脱靶效应的潜在策略是通过滴定所递送的Cas9和sgRNA的量来控制Cas9-sgRNA复合物的浓度。然而,通过减少转染DNA的量来增加特异性也导致靶上切割的减少。因此,必须考虑靶上裂解效率和脱靶效应之间的平衡。尽管如此,未来对Cas9和sgRNA设计的优化可能会提高Cas9的特异性而不会牺牲切割效率
第三,可以用Cas9的D10突变切口酶替代野生型Cas9核酸酶,并与两个仅切割一条链的sgRNA配对。配对切刻策略可在细胞系中将脱靶活性显着降低50-1,500倍,并促进小鼠受精卵中的基因敲除,而不会牺牲靶标裂解效率。这种通用策略可实现需要高基因组编辑能力的多种基因组编辑应用特异性。此外,双切口产生的两个切口的修复会产生5’突出端,从而导致插入缺失的形成要比3’突出端更频繁。与野生型Cas9和sgRNA一起共显微注射小鼠胚胎会诱导靶点和靶点关闭-后代可传播的目标突变。相反,可以在体内使用双重切口来以最小的脱靶突变有效地突变单个或多个基因,同时保留靶上的切割效率。还存在一个用于优化sgRNA配对设计的框架和用于预测sgRNA对潜在脱靶位点的计算工具。最佳的Cas9位点成尾对尾方向,相距-10 bp至+30 bp,序列5'-CCN(32–72)GG-3'。该方法可用于编辑任何模型生物的基因组,并最大限度地减少脱靶突变的混淆问题,从而在临床基因治疗中具有巨大的应用潜力。
第四,为了进一步提高DNA切割的特异性,已经产生了无催化活性的Cas9与FokI核酸酶结构域(fCas9)的融合体,其编辑目标DNA位点的特异性比野生型Cas9高140倍,比成对的Cas9高至少四倍。 这项工作为进一步表征和改善Cas9特异性和体外和体内裂解活性奠定了基础。最近,具有19 bp半位点互补长度的tru-RFN结合了截短的引导RNA和二聚化依赖性RNA引导的FokI-dCas9核酸酶,相对于标准RFN而言,脱靶切割减少了40%,为进一步提供了有用的改进工具人类细胞中的高精度基因组编辑应用。我们相信,双切口和fCas9的协同使用为缓解脱靶CRISPR / Cas9活性的影响提供了一条有希望的途径,并且可能是探索治疗方法的有用方法7最近,还报道了一种通过使用抑制剂Scr7靶向DNA连接酶IV抑制非同源末端连接来提高CRISPR-Cas9基因组精确编辑效率的策略,这为提高靶标特异性提供了另一个机会。此外,最近已经描述了一种简单有效的方法,用Cas9 mRNA或蛋白质编码化学修饰的sgRNA。这是一种有效的RNA或CRISPR / Cas9系统的基于核糖蛋白的递送方法,与基于DNA质粒的系统相比,对原代细胞的细胞毒性更低,从而使该技术得以扩展和广泛应用。
七、在基因编辑领域改进Crispr / Cas9的观点
包括CRISPR / Cas9在内的任何新技术的增长都需要逐步增强。在2年中,对CRISRP / Cas9的研究在基因编辑的发展上取得了长足的进步。 RGENs是包括ZFN和TALENs在内的不断增长的可编程核酸酶家族中一个有希望的新成员,但由于其固有的结构和机制,它们比其他核酸酶具有更严重的脱靶效应。CRISPR各种组件的优化/ Cas9系统使我们能够减少脱靶活动,而无需牺牲脱靶切割效率。此外,最小化脱靶突变的策略(图2),例如双切口酶Cas9,纯化的Cas9蛋白的递送以及dCas9与FokI核酸酶的融合,为减轻脱靶效应的路径开辟了道路,这最终可能会导致治疗应用程序。此外,用于检测脱靶突变,特别是Digenome-seq的新方法将能够在转向基因或细胞治疗之前检测出罕见的有害脱靶位点。
热衷于将CRISPR / Cas9系统用于各种应用的研究人员可以使用许多新工具。张峰研究小组建立了改进的sgRNA筛选文库,用于单载体或成对载体系统,以递送Cas9和sgRNA。此外,还可以对CRISRP / Cas9进行修饰以控制基因转录。 Donald Zack关于使用H1启动子表达的gRNA成功修饰内源基因的报告,可用于靶向AN19NGG和GN19NGG基因组位点,该报告将不断增加。 最近,另一个研究小组设计了较小的Cas9直向同源物(嗜热链球菌Cas9和金黄色葡萄球菌Cas9),其PAM特异性已改变,在人类细胞中表现出更高的特异性而不牺牲目标识别效率,从而摆脱了PAM识别的局限性。鉴于之前的众多优化和可能正在进行的大量工作,SpCas9平台可能会彻底改变基因编辑领域。通过结合所有这些可用的新方法,希望我们最终能够以具有成本效益,简单,可靠,高效和精确的方式操纵和进一步纠正许多(如果不是全部)与疾病相关的基因突变(图2)。最近,报道了CRISPR / Cpf1,它是2类CRISPR-Cas系统中另一种新的基因编辑工具,具有与CRISPR / Cas9不同的特性,其中成熟的crRNA以直接重复的19 nt开始,然后是23-25 nt间隔序列的序列(如CRISR / Cas9系统中的sgRNA)和Cpf1可以有效地切割目标DNA,然后以短T富集的PAM进行,与Cas9系统的目标DNA和交错的DNA跟随的富含G的PAM相反Cpf1产生的带有4或5个核苷酸的5’突出端的双链断裂可能提供了一种有效的方法,可通过非同源性修复机制将DNA精确地引入基因组。因此,它有可能大大提高研究人员操作真核基因组的能力。此外,其他基于DNA甲基化的基因修饰技术,遗传遗传学,或诱变剂(碱基类似物,碱基修饰剂或插入染料)可能会增强基因编辑技术,前提是它们可以与sgRNA连接。毫无疑问,除已经存在的ZFN,TALEN,CRISPR / Cas9和CRISPR / Cpf1之外,新一代的基因编辑工具可能正在开发中或正在等待大自然的探索。
参考资料
- https://www.sciencedirect.com/science/article/pii/S216225311630049X 。Molecular Therapy—Nucleic Acids (2015) 4, e264; doi:10.1038/mtna.2015.37; published online 17 November 2015
