【1.4.1】双链RNA结合基序
通过发现RNA干扰和相关现象,RNA双链体已成为人们关注的焦点。 但是,双链和高度结构化的RNA长期以来一直被认为是细胞过程中的关键角色,这些过程从RNA成熟和定位到高等生物体的抗病毒反应不等。 对这类RNA的代谢和功能的深入了解来自对包含双链RNA结合基序的蛋白质的鉴定和研究。
RNA分子由于其碱基之间以及与其他配体之间的相互作用而呈现出各种各样的二级和三级结构(图1)。 四个核碱基的碱基配对范围从标准的Watson-Crick对到各种非经典对,包括摆动(wobble),Hoogsteen,反向Hoogsteen,反向Watson-Crick和剪切对。 RNA二级和三级结构为与多种蛋白质相互作用提供了基础。 蛋白质可以通过结合单链RNA,完美双链的RNA螺旋,内部环,凸起,发夹环,假结(pseudoknots)和大量复杂的三级结构来识别RNA。 这些结构最简单的双链RNA或双链(ds)RNA在体内具有深远的调节作用。 他们被蛋白质识别 这些蛋白质的作用和进化,以及dsRNA与蛋白质相互作用的后果,是本文的主题。

RNA分子的特征是,其结构和/或序列特征与称为结构域或基序的蛋白质结构的特定模块相互作用。 RNA结合基序包括50-100个氨基酸的较大基序,例如dsRNA结合基序(dsRBM,dsRNA-binding motif),锌指和核糖核蛋白(RNP)或RNA识别MOTIF(RRM,RNA-RECOGNITION MOTIF),以及10–25个氨基酸的较短的基序 ,例如富含精氨酸的基序(ARM),K同源性(KH)基序和精氨酸–甘氨酸–甘氨酸(RGG)。 近年来,X射线晶体学和NMR技术已经解决了越来越多的RNA蛋白复合物的结构问题。 也许最值得注意的是,核糖体大小亚基的高分辨率结构提供了与RNA相互作用的近50种蛋白质的结构细节。 这些结构勾勒出一系列RNA结合基序,与RNA二级和三级基序互补。
dsRBM(又称dsRNA结合结构域(dsRBD))于1992年首次被发现,它负责蛋白质与RNA双链体的许多(尽管不是全部)相互作用(补充信息S1(表))。 在这里,我们讨论了dsRBM的结构特征,其与RNA的相互作用,其在主要物种中的分布以及包含dsRBM的那些蛋白质的功能。
一、dsRBM定义
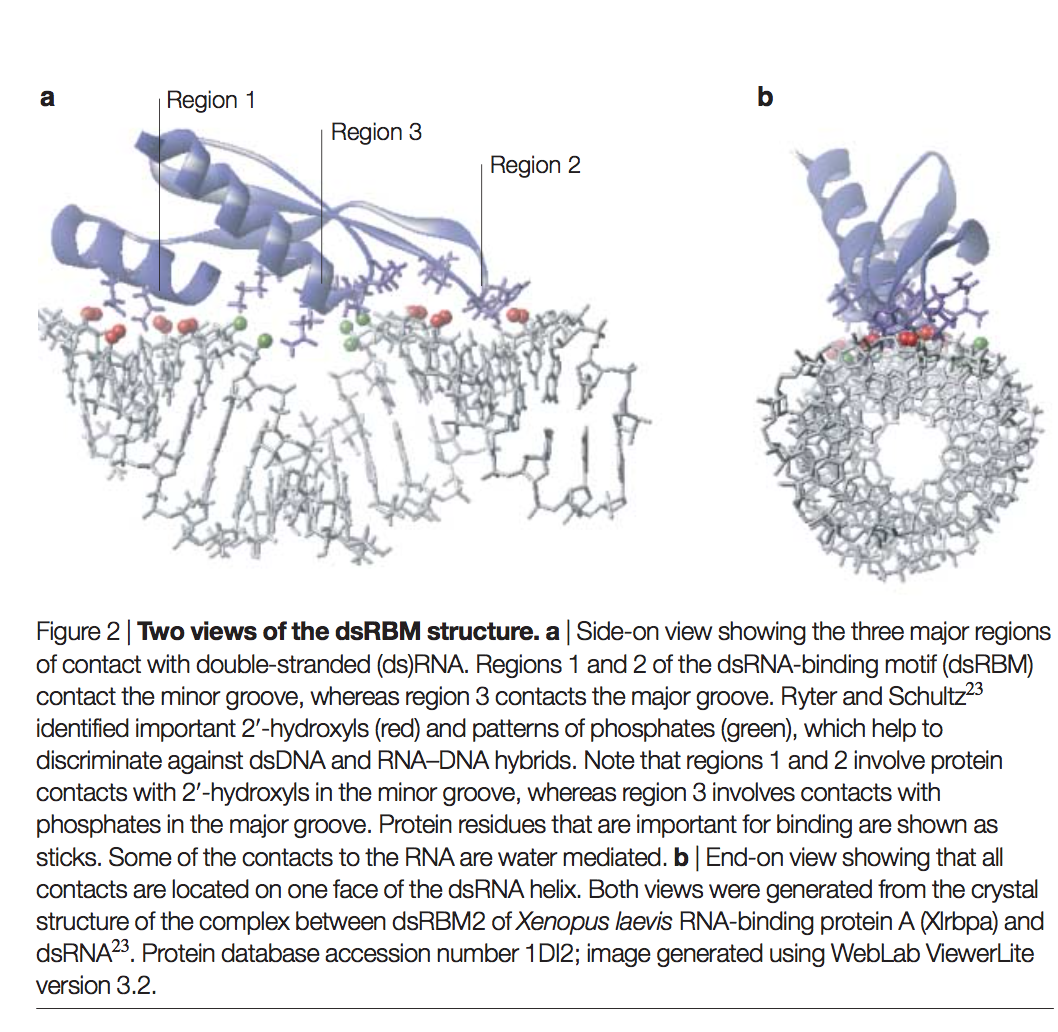
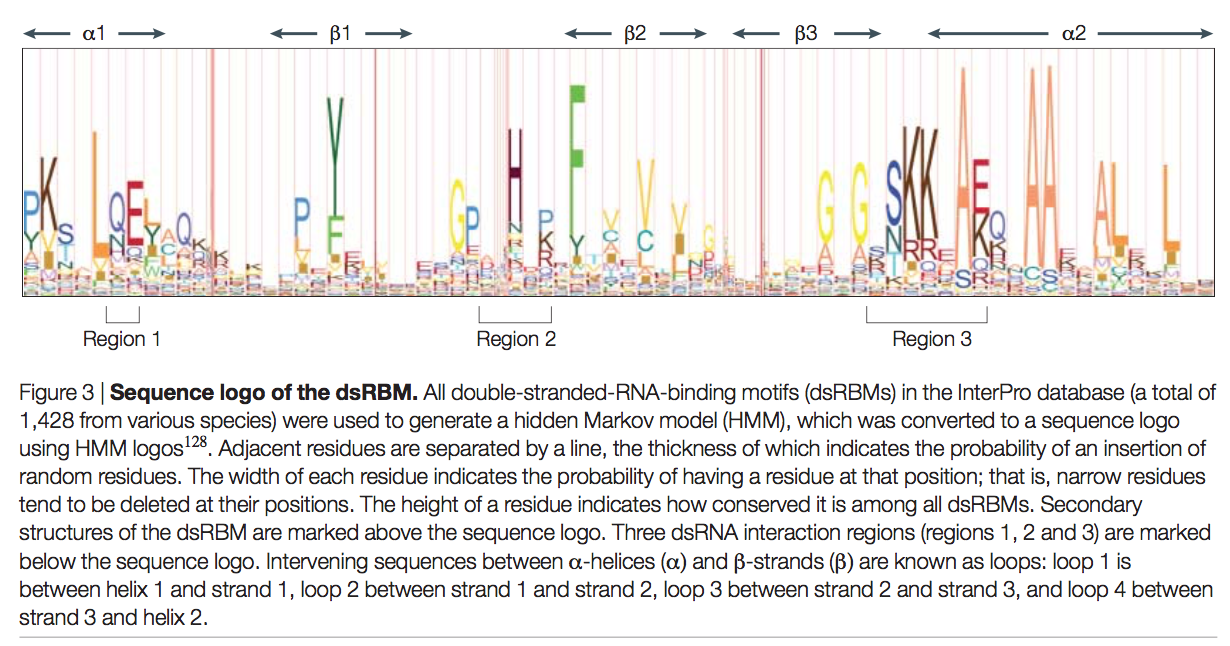
dsRBM采用α-β-β-β-α拓扑结构,其中α表示一段α螺旋,而β表示一条β链(图2a)。它形成一个α/β夹心全局折叠,类似于无处不在的RRM RNA结合基序。已经确定了来自广泛差异蛋白的dsRBM的等效三维结构。这些包括大肠杆菌核糖核酸酶RNASE III(参考文献18),果蝇果蝇蛋白Staufen,人类RNA依赖性蛋白激酶PKR和酿酒酵母RNase-III核酸内切酶Rnt1(参考文献22),通过NMR分析。 Xenopus laevis RNA结合蛋白A(Xlrbpa)以及整个Aasefex aeolicus的RNase III的dsRBM的X射线晶体学结构已经公开。保留了对dsRBM的结构和功能很重要的残基,尤其是在基序的C末端三分之一处(图3)。例如,α螺旋中的保守疏水残基沿着三链反平行β折叠的一侧堆积以维持整体结构,并且三个RNA接触区域(图3和下文)显示了高度的保守性。支持dsRBM-dsRNA相互作用的亲水性残基。尽管基序的长度通常为65-70个氨基酸,但可以容纳插入和缺失,特别是在β链和螺旋1与链1(环1),链1和2(环2)之间的连接环中。 ),以及第2和第3股(循环3)。因此,某些dsRBM远远大于平均值。例如,D。melanogaster Staufen的第二个dsRBM长83个氨基酸,在环2中具有富含脯氨酸的插入序列(该插入似乎影响域的特性;请参见下文)。如下所述,在可以将dsRBM结构划分为三个RNA接触区域中,所有序列长度变异都位于区域2中。
二、dsRBM–RNA相互作用
dsRBM与dsRNA的相互作用模式已通过X射线晶体学分析方法进行了阐明,该复合物包括一个短的合成10 bp RNA双链体和Xlrbpa或RNase III的dsRBM(参考文献24),并通过NMR分析RNA与Staufen或Rnt1的dsRBM形成复合体(参考文献20,22)。在所有情况下,如图2b所示,dsRBM仅与螺旋的一个表面结合而没有缠绕。 。在单个跨度为16bp的单个晶胞中发现了两个dsRBM模体,但仅保留了RNA链的1600-1700 Å2,这反映了蛋白质残基与RNA接触的有限表面。这种受限制的界面的结果是,有可能沿着扩展的螺旋紧密地堆积多个dsRBM,如用PKR生化显示的那样。尽管目前我们尚无与dsRNA结合的含多个dsRBM的蛋白质的高分辨率结构,但NMR研究表明,连接PKR的2个dsRBM的15个残基的连接子具有高度的柔性,这表明它应该可以将两个dsRBM紧密排列放置在同一dsRNA分子上。最近的RNase-III–dsRNA结构也显示了dsRBM如何容纳在包含其他功能域的蛋白质中,在这种情况下,该功能域是核酸内切酶域。在dsRBM和核酸内切酶结构域之间发现了一个结构灵活的七个残基连接子,从而导致了高度模块化的蛋白质。
在dsRBM–RNA复合物中,dsRNA为A形式。紧凑的A型RNA螺旋是dsRNA的特征,而dsDNA通常采用更开放的B型。 dsRBM的三个区域与dsRNA接触。区域1接触涉及dsRBM螺旋α1,区域2接触涉及环2,区域3接触涉及环4和螺旋α2。这些区域沿着dsRNA螺旋移动,顺序为1–3–2(图2a)。由于该蛋白质仅与dsRNA螺旋的一个表面结合并跨越16 bp(代表大约1.5匝螺旋),因此发现以下模式:在螺旋的小沟区域3发生区域1相互作用。主凹槽处的相互作用和小凹槽处的region-2相互作用,在翻译16 bp后已返回到螺旋的同一面。区域1和2提供了与RNA的最广泛的接触,这些区域主要涉及核糖的2'-羟基。区域3与磷酸二酯主链的非桥接氧残基进行了六个直接或水介导的接触。与此相关的是,在dsRBM和模型20 bp dsRNA之间发现了异常少量的离子相互作用,只有一个(PKR)或两个(Xlrbpa)。总的来说,缺乏强的离子结合成分,与RNA 2'-羟基基团的关键相互作用以及对A型螺旋而不是B型螺旋的凹槽尺寸的偏好阻止了与dsDNA或RNA-DNA杂种的混杂结合
蛋白质结合后,dsRNA的A形形状基本保持不变,这是不寻常的,
但是dsRBM蛋白如何与具有结构缺陷的RNA结合?确切的答案有待对这类复合物进行高分辨率的结构研究。但是,对包含凸起的弯曲RNA的实验表明,RNA可能会发生构象变化-RNA-蛋白质复合物中大多数RNA的特征。 HELICAL CHIMAERAS上的凝胶迁移率迁移实验表明,RNA趋向于采取一种线性的,类似于dsRNA的状态,该状态已经发展为可以结合蛋白质。在这个复杂的建筑中,瑕疵可能仅被容忍(见专栏1)。由Dicer处理的pre-miRNA中的螺旋缺陷似乎在序列,大小或位置上均不保守的观察进一步支持了这一观点。 dsRBM与dsRNA的一个表面结合的事实(图2b)表明了一个简单的模型,其中螺旋缺陷可能仅从RNA-蛋白结合界面上挤出。如果是这样,则在dsRBM-RNA复合体的背景下很容易容纳一系列结构缺陷。在某些情况下,这些缺陷可以充当酶功能的抑制剂或抗逆转录酶,如RNase III中所述(参考文献24,45,46)。这类抗决定簇以螺旋缺陷或侧翼RNA序列的形式存在,可能解释了为什么某些dsRNA不触发RNA干扰的原因(RNAi;见方框2)。相反,dsRBM在RNA–dsRBM复合物中保留了相当大的残留灵活性。最终复合物中高度的蛋白质柔韧性似乎可通过减少蛋白质侧链刚性化所产生的熵损失来促进结合。
三、序列特异性悖论 The sequence-specificity paradox
某些dsRBM蛋白,例如Staufen和作用于RNA(ADAR)的ADENO-SINE DEAMINASES,在与mRNA的相互作用中表现出高度的特异性。例如,由ADAR2进行的mRNA编辑对于小鼠的生命既具有高度特异性,又是必需的。在Staufen的情况下,结合需要在两个双曲面3’UTR分子之间进行“亲吻”相互作用,从而间接赋予复合物形成特异性。从结构的角度来看,尽管dsRBM和RNA碱基之间存在一些微小的凹槽接触,这似乎为序列特异性识别提供了机会23,24,但这些接触中的大多数是间接的,水介导的相互作用,以及dsRBM蛋白能够将其氢键模式调整为任何序列。少数直接的蛋白质-碱基相互作用是与存在于这四个碱基中的任何一个上的小沟氢键受体相互作用的,因此,它们提供的序列信息很少或根本没有。但是,在Xlrbpa中,有一个Pro140触点可能特定于GC碱基对23。在与相同的10 bp dsRNA复合的RNase III中,还描述了与RNA的另外15种氢键相互作用,但仅观察到鸟嘌呤和Gln161之间可能的1种可能的序列特异性相互作用。因此,很可能通过dsRNA螺旋的扭曲来完成任何序列特异性的识别,这可能使氨基酸侧链进入主沟(框1),而对于不完善的dsRNA可能会发生这种情况。
参考资料
- The double-stranded-RNA-binding motif: interference and much more 。https://www.nature.com/articles/nrm1528
