【9.3.1】polyA
聚腺苷酸化(Polyadenylation, polyA)

聚腺苷酸化是将poly(A)尾部添加到RNA转录本(通常是信使RNA(mRNA))上。polyA尾巴由多个单磷酸腺苷组成;换句话说,它是只有腺嘌呤碱基的RNA片段。
- 在真核生物中,聚腺苷酸化是产生成熟mRNA进行翻译的过程的一部分。
- 在许多细菌中,poly(A)尾巴会促进mRNA的降解。
因此,它构成了更大的基因表达过程的一部分。
聚腺苷酸化的过程开始于基因的转录终止。新制备的pre-mRNA的3'-最末端片段首先被一组蛋白质切割掉。然后这些蛋白质在RNA的3’端合成poly(A)尾巴。在某些基因中,这些蛋白质在几个可能的位点之一上添加了poly(A)尾巴。因此,与替代剪接类似,聚腺苷酸化可以从单个基因产生一个以上的转录本(替代性聚腺苷酸化)。[1]
poly(A)尾部对于核输出(nuclear export),mRNA的翻译和稳定性很重要。尾巴会随着时间的流逝而缩短,并且当它足够短时,mRNA会被酶降解。[2]然而,在少数细胞类型中,具有短poly(A)尾巴的mRNA被存储起来,以便以后在细胞质中通过重新聚腺苷酸化来激活。[3]相反,当细菌中发生聚腺苷酸化时,它会促进RNA降解。[4]真核非编码RNA有时也是如此。[5] [6]
原核生物和真核生物中的mRNA分子均具有聚腺苷酸化的3’末端,原核的poly(A)尾巴通常较短,而聚腺苷酸化的mRNA分子较少
一、 RNA的背景

RNA是一种大型生物分子,其各个组成部分称为核苷酸。 poly(A)的尾巴(用于聚腺苷酸尾巴)[8]反映了RNA核苷酸的缩写方式,该核苷酸包含的碱基带有字母(A代表腺嘌呤,C代表胞嘧啶,G代表鸟嘌呤,U代表尿嘧啶)。 。从DNA模板产生(转录)RNA。 按照惯例,RNA序列以5’至3’方向书写。 5’末端是RNA分子首先被转录的部分,而3’末端最后被转录。 3’末端也是在聚腺苷酸化RNA上发现poly(A)尾巴的地方。[1] [9]
- Messenger RNA(mRNA)是具有编码区的RNA,该编码区充当蛋白质合成(翻译)的模板。
- 其余的mRNA,即非翻译区域,可调节mRNA的活性。[10] 还有许多未翻译的RNA,称为非编码RNA。 像非翻译区一样,许多这些非编码RNA都具有调节作用
二、 Nuclear polyadenylation 核聚腺苷酸化
2.1 功能
在核聚腺苷酸化过程中,在转录结束时将poly(A)尾部添加到RNA中。在mRNA上,poly(A)尾巴可保护mRNA分子免于细胞质中的酶促降解,并有助于转录终止,mRNA从细胞核的输出和翻译。[2]
- 除了依赖动物复制的组蛋白mRNA之外,几乎所有的真核mRNA都被聚腺苷酸化[12]。
- 这些是真核生物中仅有的缺少poly(A)尾巴的mRNA,而是以茎环结构结尾,随后是富含嘌呤的序列,称为组蛋白下游元件,该序列指示将RNA切割至3’端的位置组蛋白mRNA的形成。[14]
许多真核非编码RNA总是在转录结束时被聚腺苷酸化。在小RNA中,poly(A)尾仅以中间形式出现,而在成熟RNA中则看不到,因为在加工过程中末端被去除了,值得注意的是microRNA。[15] [16]但是,对于许多长的非编码RNA(看似很大的一组调节RNA,例如包括介导X染色体失活的RNA Xist),poly(A)尾是成熟RNA的一部分
2.2 Mechanism 机制
Proteins involved:
- CPSF: cleavage/polyadenylation specificity factor
- CstF: cleavage stimulation factor
- PAP: polyadenylate polymerase
- PABII: polyadenylate binding protein 2
- CFI: cleavage factor I
- CFII: cleavage factor II
真核生物核中的进行性聚腺苷酸化复合物作用于RNA聚合酶II的产物,例如前体mRNA。在这里,一种多蛋白复合物(见右侧的成分)[18]裂解了新产生的RNA的3'-最末端,而聚腺苷酸化了裂解产生的末端。裂解是由CPSF酶催化的[13] [18],在其结合位点的下游出现10-30个核苷酸。[19]该位点通常在RNA上具有聚腺苷酸化信号序列AAUAAA,但存在与CPSF结合较弱的变体。[18] [20]另外两种蛋白质增加了与RNA结合的特异性:CstF和CFI。 CstF结合到CPSF站点下游更靠近GU的区域。[21] CFI识别RNA上的第三个位点(哺乳动物中的一组UGUAA序列[22] [23] [24]),即使AAUAAA序列缺失也可以募集CPSF。[25] [26]聚腺苷酸化信号(RNA裂解复合物识别的序列基序)在真核生物组之间有所不同。大多数人的聚腺苷酸化位点均含有AAUAAA序列,[21]但该序列在植物和真菌中较不常见。
RNA通常在转录终止前被切割,因为CstF也与RNA聚合酶II结合。[28]通过一个鲜为人知的机制(截至2002年),它提示RNA聚合酶II从转录本中滑落。[29]切割还涉及蛋白质CFII,尽管还不清楚如何。[30]与聚腺苷酸化信号相关的切割位点最多可改变约50个核苷酸。[31]
当RNA被切割时,聚腺苷酸聚合酶催化聚腺苷酸化。聚腺苷酸聚合酶通过将来自三磷酸腺苷的腺苷单磷酸单元添加到RNA,切割出焦磷酸盐来构建poly(A)尾巴。[32]另一种蛋白质PAB2与新的短的poly(A)尾部结合,并增加了聚腺苷酸聚合酶对RNA的亲和力。当poly(A)尾部大约有250个核苷酸长时,该酶便不再能够与CPSF结合,并且聚腺苷酸化作用停止,从而确定了poly(A)尾部的长度。CPSF与RNA聚合酶II接触,使其发出信号通知聚合酶终止转录。[35] [36] 当RNA聚合酶II达到“终止序列”(DNA模板上的“‘TTTATT³”和主要转录本上的“‘AAUAAA³”)时,转录结束就发出信号。[37] 聚腺苷酸化机制还与剪接体物理连接,剪接体是一种可从RNA中去除内含子的复合物。[26] 老大 22:02:33
2.3 下游效应
聚(A)尾巴充当聚(A)结合蛋白的结合位点。 聚(A)结合蛋白可促进细胞核的输出和翻译,并抑制其降解。[38] 该蛋白在从细胞核输出mRNA之前先与poly(A)尾巴结合,并且在酵母中还募集了poly(A)核酸酶,该酶缩短了poly(A)尾巴并允许mRNA的输出。 聚(A)结合蛋白与RNA一起输出到细胞质。 外来体降解未输出的mRNA。[39] [40] 聚(A)结合蛋白还可以结合并募集一些影响翻译的蛋白,[39]其中之一是起始因子4G,而后者又募集了40S核糖体亚基。[41] 但是,并非所有mRNA的翻译都需要poly(A)尾巴。[42] 此外,poly(A)拖尾(寡聚腺苷酸化)可以确定通常不是poly(A)尾巴的RNA分子(例如(小)非编码(sn)RNA等)的命运,从而诱导其RNA 衰变
2.4 腺苷酸化 Deadenylation
在真核体细胞中,细胞质中大多数mRNA的poly(A)尾巴逐渐变短,而poly(A)尾巴较短的mRNA则翻译得较少,降解得更快。[44]但是,mRNA的降解可能需要很多小时。[45]通过与mRNA的3’非翻译区互补的microRNA可以加速这种腺苷酸化和降解过程。[46]在未成熟的卵细胞中,具有缩短的poly(A)尾巴的mRNA不会被降解,而是被储存并在翻译中失活。这些短尾的mRNA在卵子受精过程中受精后被细胞质的聚腺苷酸化激活。[47]
在动物中,poly(A)核糖核酸酶(PARN)可以与5’帽结合并从poly(A)尾部去除核苷酸。接近5’帽和poly(A)尾部的水平对于控制mRNA降解的时间很重要。如果RNA被起始因子4E(在5’帽处)和4G(在poly(A)尾部)结合,则PARN的去烯基化作用降低,这就是为什么翻译可以减少去烯基化的原因。腺苷酸化的速率也可以由RNA结合蛋白调节。此外,RNA三重螺旋结构和RNA图案(例如poly(A)尾巴3’末端结合口袋)可抑制腺苷酸化过程并抑制poly(A)尾巴的去除。[48]一旦去除了poly(A)尾巴,去盖复合物就会去除5’帽,导致RNA降解。其他几种蛋白质也参与发芽的酵母和人类细胞中的腺苷酸化,最著名的是CCR4-Not复合物。
三、细胞质聚腺苷酸化 Cytoplasmic polyadenylation
在某些动物细胞类型的细胞质中,即种系中,在胚胎的早期发育过程中和在神经细胞的突触后部位,都有多聚腺苷酸化作用。 [44] [50]mRNA的poly(A)尾巴缩短,从而翻译出mRNA。[44] [50]这些缩短的poly(A)尾巴通常少于20个核苷酸,并延长至约80–150个核苷酸。[3]
在小鼠的早期胚胎中,卵细胞中的母体RNA的胞质聚腺苷酸化使该细胞得以存活并生长,即使转录直到2细胞阶段(人类的4细胞阶段)的中间才开始。[51] [ 52]在大脑中,胞质多聚腺苷酸在学习过程中很活跃,并可能在长期增强中发挥作用,这是增强神经细胞响应神经冲动而向另一细胞传递信号的信号,对于学习和记忆形成很重要。[ 3] [53]
细胞质聚腺苷酸化需要RNA结合蛋白CPSF和CPEB,并可能涉及其他RNA结合蛋白,如Pumilio。[54]根据细胞类型的不同,聚合酶可以是用于核过程的相同类型的聚腺苷酸聚合酶(PAP),也可以是胞质聚合酶GLD-2
四、替代的聚腺苷酸化
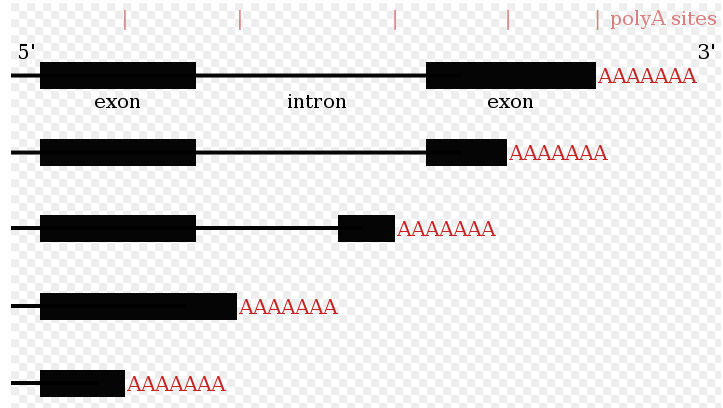
许多蛋白质编码基因具有一个以上的聚腺苷酸化位点,因此一个基因可以编码在其3’端不同的几种mRNA。[27] [56] [57]转录本的3’区域包含许多聚腺苷酸化信号(PAS, polyadenylation signals)。如果使用更近端(更靠近5’端)的PAS位点,则会缩短转录本的3’非翻译区(3’UTR)的长度。[58]对人类和苍蝇的研究均显示了组织特异性APA。神经组织倾向于使用远端PAS,从而导致较长的3’UTR,而睾丸组织则倾向于使用近端PAS,从而导致较短的3’UTR。[59] [60]研究表明,基因的保守水平与其进行多聚腺苷酸替代趋势之间存在相关性,高度保守的基因显示出更多的APA。同样,高表达基因也遵循相同的模式。[61]核糖测序数据(仅核糖体内部的mRNA测序)表明,具有较短3’UTR的mRNA亚型更可能被翻译
由于可替代的聚腺苷酸化改变了3’UTR的长度,[62]它也可以改变3’UTR中可用于microRNA的结合位点。[19] [63] MicroRNA往往会抑制翻译并促进与其结合的mRNA的降解,尽管有稳定转录本的microRNA实例。[64] [65]替代的聚腺苷酸化也可以缩短编码区,从而使mRNA编码不同的蛋白质,[66] [67],但这远比仅仅缩短3’非翻译区少得多。[27]
聚(A)位点的选择会受到细胞外刺激的影响,并取决于参与聚腺苷酸化的蛋白质的表达。[68] [69]例如,响应于脂多糖(一组触发免疫应答的细菌化合物),巨噬细胞中CstF-64(裂解刺激因子(CstF)的一个亚基)的表达增加。这导致选择弱的poly(A)位点,从而缩短了转录本。这去除了国防相关产品(如溶菌酶和TNF-α)的mRNA 3’非翻译区中的调控元件。这些mRNA的半衰期更长,并产生更多的这些蛋白。[68]除了聚腺苷酸化机制中的蛋白以外的RNA结合蛋白也会影响是否使用聚腺苷酸化位点,[70] [71] [72] [73]也会影响聚腺苷酸化信号附近的DNA甲基化
五、标记真核生物降解 Tagging for degradation in eukaryotes
对于许多非编码RNA,包括tRNA,rRNA,snRNA和snoRNA,多腺苷酸化是标记RNA至少在酵母中降解的一种方法。[75] 这种多腺苷酸化作用是通过TRAMP复合物在细胞核中完成的,该复合物在3’端保留了一条约4个核苷酸长的尾巴。[76] [77] 然后RNA被外来体降解。[78] 在人rRNA片段上也发现了Poly(A)尾巴,既有均聚尾巴(仅A)形式,也有杂聚尾巴(大多为A)形式
六、In prokaryotes and organelles 在原核生物和细胞器中
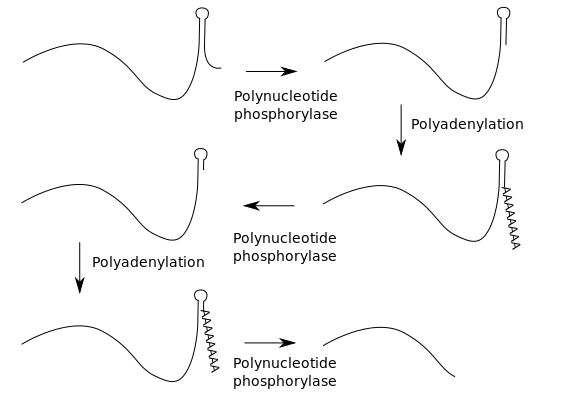
在许多细菌中,mRNA和非编码RNA均可被聚腺苷酸化。 这种多聚(A)尾巴促进了降解体的降解,该降解体包含两种RNA降解酶:多核苷酸磷酸化酶和RNaseE。多核苷酸磷酸化酶结合到RNA的3’端,而聚(A)尾巴提供的3’延伸允许 它可以与RNA的二级结构结合,否则该RNA的二级结构会阻断3’端。 多核苷酸磷酸化酶的连续轮聚腺苷酸化和3’端降解使得降解体可以克服这些二级结构。 poly(A)尾巴也可以募集将RNA切成两半的RNase。[80] 这些细菌的poly(A)尾巴长约30个核苷酸。[81]
与动物和锥虫一样,线粒体包含稳定和不稳定的poly(A)尾巴。不稳定的聚腺苷酸化同时靶向mRNA和非编码RNA。聚(A)尾巴平均长43个核苷酸。稳定密码子始于终止密码子,而没有它们的终止密码子(UAA)并不完整,因为基因组仅编码U或UA部分。植物线粒体仅具有不稳定的聚腺苷酸化作用。从未在萌芽或裂变酵母中观察到线粒体聚腺苷酸化。 [82] [83]
尽管许多细菌和线粒体都具有聚腺苷酸聚合酶,但它们也具有另一种类型的聚腺苷酸化,这是由多核苷酸磷酸化酶本身完成的。这种酶存在于细菌,[84]线粒体,[85]质体[86]中,并且是古细菌外泌体的成分(在那些具有外泌体的古细菌中)。[87]它可以合成3’延伸,其中绝大多数碱基是腺嘌呤。像细菌中一样,多核苷酸磷酸化酶的聚腺苷酸化作用可促进质体中RNA的降解[88],也可能促进古细菌[82]的降解。
七、进化
尽管在几乎所有生物中都可见到聚腺苷酸化,但这不是普遍的。[7] [89] 但是,这种修饰的广泛分布以及它存在于生命的所有三个领域的生物中的事实表明,假定所有活生物体的最后一个普遍祖先具有某种形式的聚腺苷酸化系统。[81] 少数生物不会聚腺苷酸化mRNA,这意味着它们在进化过程中失去了聚腺苷酸化机制。 尽管尚无缺乏多腺苷酸化的真核生物的例子,但来自鸡支原体支原体和耐盐古细菌Haloferax volcanii的mRNA缺乏这种修饰。[90] [91]
最古老的聚腺苷酸化酶是多核苷酸磷酸化酶。该酶是细菌降解体和古细菌外来体的一部分,[92]这两个紧密相关的复合物可将RNA循环成核苷酸。该酶通过用磷酸盐攻击最3’端核苷酸之间的键来降解RNA,从而使二磷酸盐核苷酸断裂。该反应是可逆的,因此该酶还可以扩展具有更多核苷酸的RNA。多核苷酸磷酸化酶添加的杂聚尾巴富含腺嘌呤。腺嘌呤的选择很可能是由于使用ATP作为能量货币而导致的ADP浓度高于其他核苷酸的结果,使它更有可能被掺入早期生命形式的尾巴中。有人提出,富含腺嘌呤的尾巴参与RNA降解会促使聚腺苷酸聚合酶(产生没有其他核苷酸的聚(A)尾巴的酶)的后期进化。[93]
聚腺苷酸聚合酶并不那么古老。它们已经从添加CCA的酶(即完成tRNA 3’末端的酶)在细菌和真核生物中分别进化。它的催化结构域与其他聚合酶的催化结构域同源。[78]据推测,细菌CCA添加酶向真核生物的水平转移使古细菌样CCA添加酶能够将功能切换为poly(A)聚合酶。[81]一些古生物,例如古细菌和蓝细菌,从未进化出聚腺苷酸聚合酶。[93]
在几种RNA病毒中观察到了聚腺苷酸尾巴,其中包括甲型流感,[94]冠状病毒,[95]苜蓿花叶病毒,[96]和鸭肝炎[97]。一些病毒,例如HIV-1和脊髓灰质炎病毒,会抑制细胞的poly-A结合蛋白(PABPC1),以强调其自身基因在宿主细胞上的表达。[98]
八、历史
聚(A)聚合酶于1960年首次被鉴定为一种在细胞核提取物中的酶活性,该提取物可以将ATP(而非ADP)聚合成聚腺嘌呤。[99] [100] 尽管在许多类型的细胞中都有发现,但这种活性直到1971年才知道,当时在mRNA中发现了poly(A)序列。[101] [102] 最初认为这些序列的唯一功能是保护RNA的3’端不受核酸酶的影响,但后来确定了聚腺苷酸化在核输出和翻译中的特定作用。 负责多腺苷酸化的聚合酶在1960年代和1970年代首次被纯化和鉴定,但是控制该过程的大量辅助蛋白仅在1990年代初才被发现。
参考资料
