【3.1】核酸结构测定
确定核酸(如RNA和DNA)结构的实验方法主要可分为生物物理方法和生物化学方法。
- 生物物理(Biophysical)方法使用分子的基本物理特性进行结构测定,包括X 射线晶体学、核磁共振和冷冻电镜。
- 生化方法(iochemical)利用核酸的化学性质,使用特定的试剂和条件来分析核酸的结构。[1]此类方法可能涉及使用特定试剂进行化学探测,或依赖于天然或类似化学。
不同的实验方法具有独特的优点,适用于不同的实验目的。
一、 生物物理方法
X射线晶体学
X 射线晶体学对于单独的核酸并不常见,因为 DNA 和 RNA 都不容易形成晶体。这是由于核酸结构和带负电荷的(脱氧)核糖-磷酸骨架的内在无序和动态程度更高,它们在近距离相互排斥。因此,结晶核酸倾向于与感兴趣的蛋白质复合以提供结构秩序并中和负电荷。
核磁共振波谱 (NMR,Nuclear magnetic resonance spectroscopy)
核酸核磁共振是使用核磁共振波谱来获取有关核酸分子(如DNA或RNA)的结构和动力学的信息。截至 2003 年,近一半的已知 RNA 结构已通过核磁共振波谱法确定。[2]
核酸 NMR 使用与蛋白质 NMR 类似的技术,但有几个不同之处。
- 核酸的氢原子百分比较小,这是在 NMR 中通常观察到的原子,
- 并且由于核酸双螺旋是刚性的且大致呈线性,因此它们不会自行折叠以提供“长程”(long-range)相关性。
[3] 通常对核酸进行核磁共振的类型有1 H 或质子核磁共振、13 C 核磁共振、15 N 核磁共振和31 P 核磁共振。 二维核磁共振几乎总是使用的方法,例如相关光谱 (COSY) 和全相干转移光谱 (TOCSY) 来检测通过键核耦合,以及核奥弗豪泽效应光谱 (NOESY) 来检测空间中彼此靠近的核之间的耦合. [4]
从光谱中获取的参数,主要是 NOESY 交叉峰和耦合常数,可用于确定局部结构特征,例如糖苷键角、二面角(使用Karplus 方程)和糖褶构象(sugar pucker)。对于大尺度结构,这些局部参数必须辅以其他结构假设或模型,因为随着双螺旋穿过,误差会增加,并且与蛋白质不同,双螺旋没有紧凑的内部并且不会折叠本身。核磁共振也可用于研究非标准几何形状,如弯曲螺旋、非沃森-克里克碱基配对和同轴堆叠. 它在探索天然 RNA 寡核苷酸的结构方面特别有用,这些寡核苷酸往往采用复杂的构象,如茎环和假结。NMR 还可用于探测核酸分子与其他分子(例如蛋白质或药物)的结合,通过观察其他分子结合时哪些共振发生了变化
低温电子显微镜 (cryo-EM,Cryogenic electron microscopy)
低温电子显微镜(cryo-EM) 是一种使用电子束对在水溶液中低温保存的样品进行成像的技术。液体样品被移到小金属网格上,并浸入液态乙烷/丙烷溶液中,该溶液通过液氮浴保持极冷。在这个冷冻过程中,样品中的水分子没有足够的时间形成冰中发现的六边形晶格,因此样品保存在玻璃状水状状态(也称为玻璃化冰)),使这些样品更容易使用电子束成像。
- 与 X 射线晶体学相比,冷冻 EM 的一个优点是样品以水溶液状态保存,不会因形成样品晶体而受到干扰。
- 一个缺点是难以分辨小于 ~75千道尔顿的核酸或蛋白质结构,部分原因是难以有足够的对比度来定位这种玻璃化水溶液中的颗粒。
- 另一个缺点是,要获得有关样品的原子级结构信息,需要拍摄许多图像(通常称为电子显微照片)并在称为单粒子重建的过程中对这些图像进行平均。这是一个计算密集型的过程。
Cryo-EM 是一种更新的、干扰较少的透射电子显微镜(TEM) 版本。它的扰动较小,因为样品没有干燥到表面上,这种干燥过程通常在负染色 TEM 中完成,并且因为 Cryo-EM 不需要像重金属盐(例如乙酸铀酰或磷钨酸)这样的造影剂,这也可能会影响生物分子的结构。透射电子显微镜作为一种技术,利用这样一个事实,即样品与电子束相互作用,并且只有样品中不与电子束相互作用的部分才能“传输”到电子检测系统上。一般来说,自 1960 年代以来,TEM 一直是确定核酸结构的有用技术。[5] [6]虽然双链 DNA (dsDNA) 结构在传统上可能不被认为是结构,但在单链和双链区域交替片段的典型意义上,实际上,dsDNA 不仅仅是在其长度的每个位置上完美有序的双螺旋由于 DNA 中的热波动和可以形成类似g-四链体的替代结构。已对核糖体、[7]病毒 RNA、[8]和病毒内的单链 RNA 结构进行了核酸的 CryoEM 。[9] [10]这些研究已经解决了从核碱基水平(2-3 埃)到三级结构基序(大于纳米)的不同分辨率下的结构特征。
二、化学探测 Chemical probing
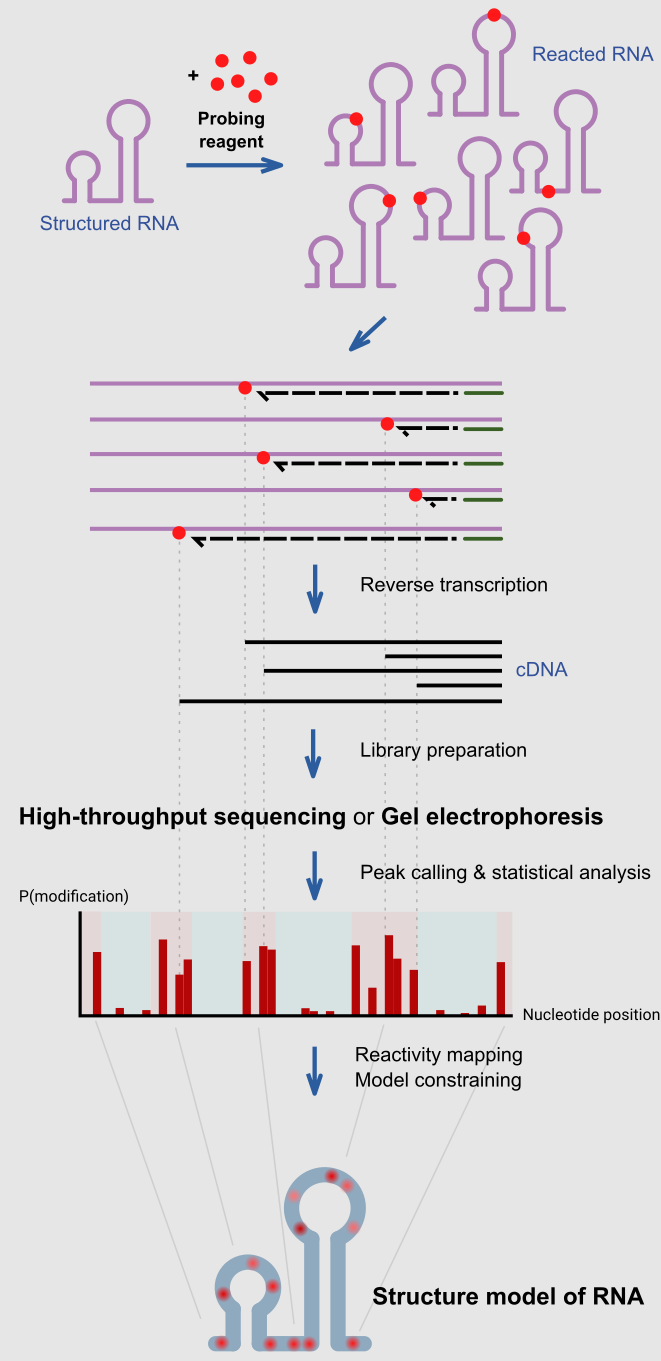
示意图解释了在典型的化学探测实验中分析 RNA 分子结构的步骤。
RNA 化学探测使用与 RNA 反应的化学物质。重要的是,它们的反应性取决于局部 RNA 结构,例如碱基配对或可及性。因此,反应性的差异可以作为沿着序列的结构足迹。不同的试剂在 RNA 结构的不同位置发生反应,具有不同的反应谱。[1]最近的进展允许同时研究许多 RNA 的结构(全转录组探测)[11]以及在其细胞环境中直接测定 RNA 分子(细胞内探测)。[12]
在给定的孵育时间内,结构化 RNA 首先与探测试剂反应。这些试剂将在反应位点的 RNA 上形成共价加合物。当使用逆转录酶将 RNA逆转录成 DNA 拷贝时,生成的 DNA 在反应位置被截断,因为酶被加合物阻断。因此,各种截短长度的 DNA 分子的集合会告知每个碱基位置的反应频率,这反映了沿 RNA 的结构分布。这在传统上是通过在凝胶上运行 DNA 来测定的,条带的强度告知在每个位置观察截断的频率。最近的方法使用高通量测序以更高的通量和灵敏度达到同样的目的。
反应性曲线可用于研究特定假设的特定位置的结构程度,或与计算算法结合使用以生成完整的实验支持的结构模型。[13]
根据所使用的化学试剂,一些试剂,例如羟基自由基,会改为裂解 RNA 分子。截短的 DNA 中的结果是相同的。一些试剂,例如 DMS,有时不会阻断逆转录酶,而是在 DNA 拷贝中的位点触发错误。这些可以在使用高通量测序方法时检测到,有时用于改进作为突变分析 (MaP) 的探测结果。[14] [15]
RNA 上的位置不仅可以通过局部结构而且可以通过该位置上的结合蛋白来保护其免受试剂的影响。这导致一些工作使用化学探测来分析蛋白质结合
羟基自由基探测 Hydroxyl radical probing
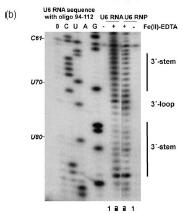
羟基自由基探测凝胶在指示保护强度的位置和点处显示条带。[17]
由于羟基自由基在溶液中的寿命很短,因此需要在实验中产生。这可以使用 H2 O2、抗坏血酸和 Fe(II)-EDTA 复合物来完成。这些试剂形成一个系统,通过芬顿化学产生羟基自由基。然后羟基自由基可以与核酸分子反应。[17]羟基自由基攻击核糖/脱氧核糖环,这导致糖-磷酸骨架的断裂。受结合蛋白或 RNA 三级结构保护的位点会以较低的速率被羟基自由基切割。[17]因此,这些位置将显示为凝胶上没有条带,或通过测序显示低信号
DMS
硫酸二甲酯(Dimethyl sulfate),称为 DMS,是一种化学物质,可用于修饰核酸以确定二级结构。与 DMS 的反应在位点添加甲基加合物,称为甲基化。特别是,DMS 甲基化腺嘌呤 (A) 的N1和胞嘧啶 (C) 的N3 ,[19]两者均位于碱基配对时的天然氢键位点。因此,修饰只能发生在单链的 A 和 C 核碱基上,在螺旋末端碱基配对,或在 GU摆动对处或旁边的碱基对中,后两个是碱基配对偶尔会打开的位置。此外,由于修饰位点不能进行碱基配对,因此可以通过 RT-PCR 检测修饰位点,其中逆转录酶在甲基化碱基处脱落并产生不同的截短 cDNA。这些截短的 cDNA 可以通过凝胶电泳或高通量测序进行鉴定。
改进基于截断的方法,带测序的 DMS 突变分析 (DMS-MaPseq) 可以检测单个 RNA 分子中的多个 DMS 修饰,这使得每次读取可以获得更多信息(对于 150 nt 的读取,通常为两到三个突变)位点,而不是零到一个截断位点),确定低丰度 RNA 的结构,并识别具有替代二级结构的 RNA 亚群。[20] DMS-MaPseq 使用热稳定的 II 组内含子逆转录酶(TGIRT) 在cDNA中产生突变(而不是截断)当它遇到一个被 DMS 甲基化的碱基时,否则它会以高保真度逆转录。对得到的 cDNA 进行测序,以确定哪些碱基在逆转录过程中发生了突变;这些碱基不可能在原始 RNA 中进行碱基配对。
DMS 修饰也可用于 DNA,例如用于 DNA-蛋白质相互作用的足迹
SHAPE
Selective 2′-hydroxyl acylation analyzed by primer extension, or SHAPE,需要的试剂优先修改RNA的主链在结构上的柔性区域的优势。
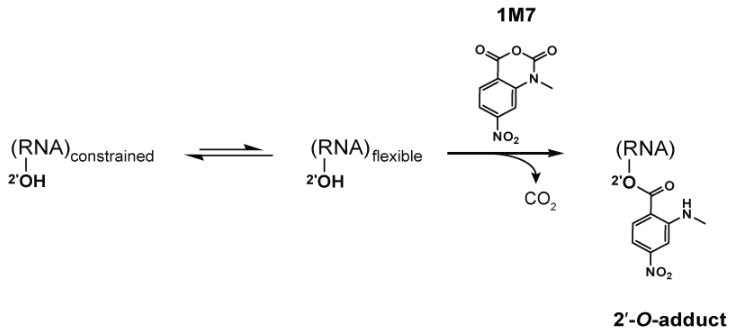
1-methyl-7-nitroisatoic anhydride (1M7) 发生水解,在未配对的 RNA 核苷酸的骨架上形成加合物。
N-甲基蕈酸酐 (NMIA) 和 1-甲基-7-硝基茚酸酐 (1M7) [22] 等试剂与 2'-羟基反应,在 RNA 骨架的 2'-羟基上形成加合物。与其他 RNA 探测技术中使用的化学物质相比,这些试剂的优点是在很大程度上不受碱基身份的影响,同时对构象动态保持非常敏感。受限制(通常通过碱基配对)的核苷酸比未配对的核苷酸显示更少的加合物形成。通过使用逆转录酶延伸互补 DNA 引物并将所得片段与未修饰对照的片段进行比较,对给定 RNA 中每个核苷酸的加合物形成进行量化。[23] 因此,SHAPE 报告了单个核苷酸水平的 RNA 结构。该数据可用作输入以生成高度准确的二级结构模型。[24] SHAPE 已被用于分析各种 RNA 结构,包括整个 HIV-1 基因组的结构。[25] 最好的方法是结合使用化学探测试剂和实验数据。[26]在 SHAPE-Seq 中,SHAPE 通过基于条形码的多路复用与RNA-Seq相结合进行扩展,并且可以以高通量方式执行
二亚胺 Carbodiimides
所述碳二亚胺部分还可以在暴露的核碱基,其是形成共价加合物尿嘧啶,和较小程度鸟嘌呤,在通过中的脱质子N.亲核攻击它们与尿嘧啶的N3和N1鸟嘌呤修改负责氢键两个位点的主要反应基地。[19]
1-环己基-(2-吗啉乙基)碳二亚胺甲基对甲苯磺酸盐,也称为CMCT或CMC,是RNA结构探测中最常用的碳二亚胺。[29] [30]与 DMS 类似,它可以通过逆转录和凝胶电泳或高通量测序来检测。由于它对 G 和 U 具有反应性,因此可用于补充来自 DMS 探测实验的数据,这些数据为 A 和 C 提供信息。[31]
1-乙基-3-(3-二甲氨基丙基)碳二亚胺,也称为EDC,是一种水溶性碳二亚胺,表现出与CMC相似的反应性,也用于RNA结构的化学探测。EDC 能够渗透到细胞中,因此用于在其天然环境中直接细胞内探测 RNA
酮醛、乙二醛和衍生物 Kethoxal, glyoxal and derivatives
一些 1,2-二羰基化合物能够在 N1 和 N2 处与单链鸟嘌呤 (G) 反应,在 Watson-Crick 面形成五元环加合物。
1,1-二羟基-3-乙氧基-2-丁酮,也称为酮醛,具有与 1,2-二羰基相关的结构,是该类别中第一个广泛用于 RNA 化学探测的物质。酮醛导致鸟嘌呤的修饰,特别是通过共价相互作用同时改变 N1 和环外氨基 (N2)。[35]
乙二醛、甲基乙二醛和苯基乙二醛都带有关键的 1,2-二羰基部分,都与类似于酮醛的游离鸟嘌呤反应,可用于探测结构化 RNA 中未配对的鸟嘌呤碱基。由于它们的化学特性,这些试剂可以很容易地渗透到细胞中,因此可用于检测天然细胞环境中的 RNA
激光或 Naz 探测 ER or NAz Probing
RNA 的光活化结构检查 (LASER) 探测利用紫外光激活烟酰叠氮化物 (NAz),在水中产生高反应性氮烯阳离子,通过无障碍弗里德尔-工艺品反应。LASER 探测目标是单链和双链残基,只要它们是可被溶剂接触到的。由于羟基自由基探测需要同步辐射来测量体内RNA 的溶剂可及性,因此许多实验室很难将羟基自由基探测应用于细胞中的足迹 RNA。相比之下,激光探测使用手持式紫外线灯 (20 W) 进行激发,在体内应用激光探测要容易得多研究 RNA 溶剂的可及性。这种化学探测方法是光可控的,可以探测核碱基的溶剂可及性,这已被证明可以在细胞内足迹 RNA 结合蛋白。
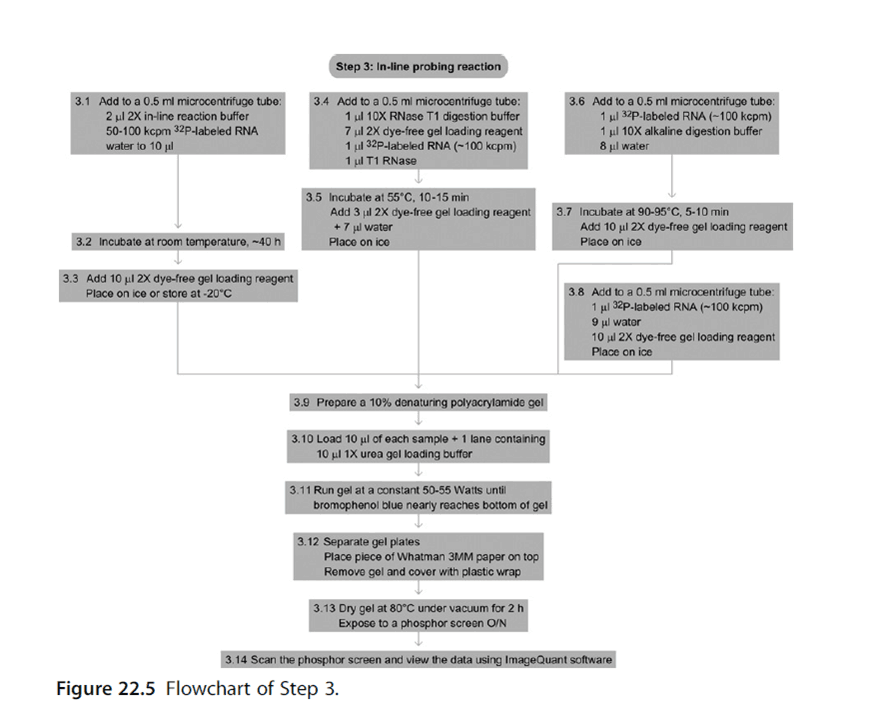
三、在线探测 In-line probing
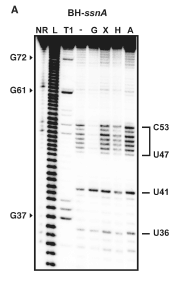
鸟嘌呤核糖开关的在线探测分析显示响应各种核苷酸配体的灵活性变化[37]
在线探测不涉及用任何类型的化学品或试剂处理来修饰 RNA 结构。这种类型的探测分析使用 RNA 的结构依赖性切割;单链区域更加灵活和不稳定,并且会随着时间的推移而退化。[38]在线探测过程通常用于确定由于配体结合引起的结构变化。配体的结合可导致不同的切割模式。在线探测的过程涉及长时间孵育结构或功能 RNA。这段时间可以是几天,但在每个实验中都不同。然后将孵育的产品在凝胶上运行以观察条带。该实验通常使用两种不同的条件进行:1) 有配体和 2) 没有配体。[37] 切割导致更短的条带长度,并指示未碱基配对的区域,因为碱基配对区域往往对自发切割不那么敏感。[38] 在线探测是一种功能测定,可用于确定 RNA 响应配体结合的结构变化。它可以直接显示 RNA 区域响应配体的灵活性和结合的变化,并将该响应与类似配体进行比较。该测定常用于动态研究,特别是在检查核糖开关时
- Mikkola S., Kaukinen U., Lonnberg H. The effect of secondary structure on cleavage of the phosphodiester bonds of RNA. Cell Biochem. Biophys. 2001; 34:95–119. https://link.springer.com/content/pdf/10.1385/CBB:34:1:95.pdf
- Regulski E.E., Breaker R.R. In-line probing analysis of riboswitches. Methods Mol. Biol. 2008; 419:53–67. https://link.springer.com/protocol/10.1007/978-1-59745-033-1_4
四、核苷酸模拟干扰映射 (NAIM,Nucleotide analog interference mapping)
核苷酸类似物干扰作图 (NAIM) 是使用核苷酸类似物(在某些方面与核苷酸相似但缺乏功能的分子)来确定 RNA 分子每个位置的功能组重要性的过程。[39] [40] NAIM 的过程是将单个核苷酸类似物插入一个独特的位点。这可以通过使用T7 RNA 聚合酶转录短 RNA 来完成,然后合成在特定位置包含类似物的短寡核苷酸,然后使用连接酶将它们在 DNA 模板上连接在一起。[39] 核苷酸类似物用硫代磷酸酯标记,然后将 RNA 群体的活性成员与非活性成员区分开来,然后去除非活性成员的硫代磷酸酯标签,并使用凝胶电泳和放射自显影术鉴定类似物位点。[39] 这表明这是一个功能上重要的核苷酸,因为硫代磷酸酯被碘切割导致在核苷酸类似物插入位点切割的 RNA。通过在凝胶上运行这些截短的 RNA 分子,可以根据测序实验鉴定感兴趣的核苷酸[40] 定点掺入结果表明在凝胶上运行时的重要位置,在该位置掺入类似物的功能性 RNA 将具有一条带,但如果类似物导致非功能性,当功能性 RNA 分子在凝胶上运行时凝胶上将没有对应于该位置的条带。[41] 该过程可用于评估整个区域,其中类似物被放置在特定位置,仅一个核苷酸不同,然后当功能性 RNA 被分离并在凝胶上运行时,所有产生条带的区域都表明非-必需的核苷酸,但功能性 RNA 中不存在条带的区域表明在该位置插入核苷酸类似物会导致 RNA 分子变得无功能
参考资料
