【1.1.1.2】小核酸药物
一、宝剑锋从磨砺出,技术突破引领新发展
1.1 小核酸药物发展过程曲折,历经浮沉
小核酸药物作为诺贝尔奖级理论的临床实践,堪称人类疾病治疗领域的革命性技术进步,但其发展并非一帆风顺。我们认为,小核酸药物的发展历程可以概括为发现期、探索期、低 谷期、发展期。
- 发现期:1978 年哈佛大学科学家 Zamecnik等人首次提出反义核酸概念。 1998 年,FDA 批准了全球首款 ASO 药物 Vitravene 上市,用于治疗艾滋病人的眼部 CMV 病毒感染。同年,Andrew Fire 和 Craig Mello 在线虫中首次揭示了 RNAi 现象,两人也因此 荣获 2006 年诺贝尔生理学与医学奖。2001 年 Tuschl 等首次利用体外合成的 siRNA实现了哺 乳动物细胞中的基因表达调控,标志着 RNAi 拥有了从研究走向制药的潜力,同年,RNAi 技 术被 Science 杂志评为 2001 年的十大科学进展之一。
- 探索期:2004 年,OPKO公司用 于湿性老年性黄斑变性病的第一个 siRNA药物 Bevasiranib进入临床试验,之后大型制药企业 罗氏、默克、辉瑞、赛诺菲、雅培等纷纷进入这一领域,投入了数十亿美元资金,小核酸药 物研发迎来快速探索期。
- 低谷期:然而,由于 siRNA在体内不稳定、以及潜在的免疫原 性等问题无法解决,小核酸药物的发展一度在 2009 年至 2013 年陷入低谷期,资本的离场让 小核酸药物研发陷入寒冬。
- 发展期:不过,以 Alnylam 为代表的创新生物技术企业一直 在潜心探索新技术,在 2013 年后,以 GalNAc 缀合技术和增强的稳定化学修饰技术为代表的 新技术出现极大地促进和推动了小核酸制药的快速复苏。2016 年,Sarepta Therapeutics 和 Ionis 研发的 2 款 ASO 药物先后被 FDA 批准上市。2018 年,Ionis 和 Alnylam 的两款治疗由 hATTR 引起的多发性神经病的孤儿药陆续获批,其中 Patisiran 成为全球第一个获批的 siRNA 类药物。2020 年,黑石宣布投资 20 亿美元于 Alnylam 公司研发 siRNA药物。
目前,全球有 超过 20 余款 siRNA药物,50 余款 ASO药物处于临床研究阶段,治疗领域覆盖中枢神经系统、 心血管、抗感染和抗肿瘤等。
1.2 关键技术突破,小核酸产业化瓶颈问题终将解决
小核酸药物开发过程中最大的难题是避免快速被降解并精准进入靶向细胞发挥治疗功能。 在药物设计与合成方面,目前国内外均有相当成熟的技术,随着基因测序技术的发展,测序成 本降低,为小核酸药物产业化提供了可能。在小核酸药物的开发过程中最大的难点是向病人注 射小核酸药物后,药物如何在体内存留足够长的时间、并精准进入靶向细胞发挥治疗功能,同 时最大程度的避免误伤正常细胞。
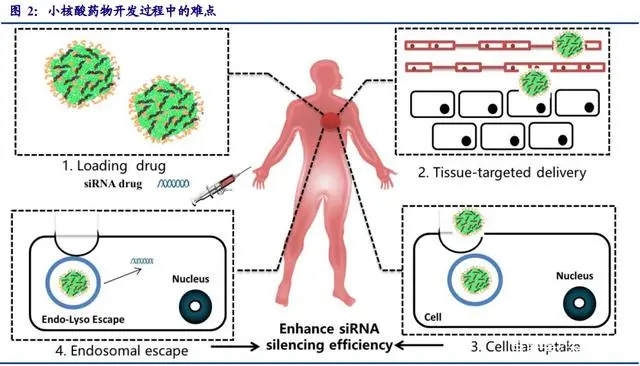
化学修饰与递送系统的技术突破推动小核酸药物产业化进程。小核酸在血液中不稳定极 易被降解,同时可能会触发人体免疫应答反应,并且不易穿过细胞膜进入细胞。因此,小核酸 药物进入人体发挥治疗作用需要克服几个关键问题:
- 如何避免入血后被快速清除并延长 半衰期;
- 如何避免被核酸酶降解;
- 如何提高组织渗透性,靶向目标细胞并提高细胞 摄取效率;
- 如何有效地实现内涵体逃逸。
随着技术突破,部分难题目前得到较好的解决 办法,其中化学修饰可以避免核酸药物被核酸酶降解并延长半衰期,高效安全的递送系统可以 使核酸药物精准的靶向目标细胞并提高细胞摄取效率,使核酸药物发挥治疗功能。
1.3. 化学修饰技术增强小核酸药物在血液中的稳定性并降低免疫原性
核酸在体内不稳定,进入血液之后极易被核酸酶降解,且容易通过肾脏清除,半衰期短, 同时外源的核酸分子具有免疫原性,容易引起人体的免疫反应。
化学修饰技术可以较好地解决 上述问题,目前常用的核苷酸化学修饰技术包括磷酸骨架(硫代磷酸 PS)、核糖(对核糖结 构中 2 位的羟基/氢进行改造,如 2’-OME,2’-F)、核糖五元环改造(如 LNA、PNA、PMO 等)、碱基(胞嘧啶甲基化)、核苷酸练末端改造(3’端添加反式胸苷)。常见核酸药物化 学修饰技术如下图所示。
1.4 递送系统可提升小核酸药物胞吞效率
小核酸药物从进入人体到发挥药物作用主要经历逃避核酸酶清除、靶向组织细胞、实现胞 吞、内涵体逃逸。尽管化学修饰能够解决稳定性和免疫原性的问题,但如果不能进入细胞实现 胞吞,小核酸药物依然不能发挥药物作用。这一瓶颈问题一度难以解决,阻滞小核酸药物产业 化进程。
随着技术的不断进步,递送系统成为解决这一瓶颈问题的关键办法。目前应用于小核 酸药物研发的递送系统在尺寸、形状、结构、化学性质和作用机制上都不是完全相同的,这种 多样性反应了研究者们对大部分递送过程背后机制的理解仍在不断发展,展现出了小核酸递送 领域创新的巨大空间。我们主要从材料设计和递送方法方面总结具有应用前景的小核酸递送系 统。
1.4.1 环糊精纳米聚合物(Cyclodextrin Polymer Nanoparticles, CDP):
环糊精聚合物为阳离子低聚物(n≈5),是带二胺的环糊精单体和二甲基琥珀酰亚胺酯通 过聚合反应合成产生的带有脒官能团的低聚物。这些脒基的强碱性使得核酸与 CDP 在氮/磷比 例低至 3 时就可以进行高效负载。用咪唑官能团封端聚合物末端可以帮助内体逃逸,使得质粒 DNA 和 siRNA 的递送效率提高。目前的研究已经在几种与治疗相关的动物模型中评估了 CDP-siRNA递送系统。在尤文肉瘤的异种移植模型中,siRNA与 CDP 纳米颗粒结合,用以靶 向致癌的 EWS-FLI1 融合基因。这些诱导基因被沉默,并产生了抗增殖效应,并且静脉内给药 时没有产生先天性免疫反应。在小鼠皮下肿瘤模型中,靶向的 CDP 递送系统显示出针对核糖 核苷酸还原酶亚基 2的有效沉默。在食蟹猴中评估递送系统的临床可行性,证明其可以耐受的 给药剂量高达 27mg/kg。最后,通过监测 siRNA介导的 RRM2 mRNA裂解,显示出 siRNA可 沉默人黑色素瘤患者(I 期临床试验)体内的靶基因,显示出 CDP-siRNA 递送系统的临床潜 力。

1.4.2 脂质纳米颗粒(Lipid Nanoparticles, LNP)
脂质体 siRNA制剂的活性首次于 2016 年在非人灵长类体内被证实。自此,许多脂质纳米 颗粒(LNP)RNAi 药物已进入临床试验,包括针对高胆固醇血症,转甲状腺素蛋白介导的淀 粉样变性和癌症的治疗。在用于 siRNA之前,脂质体作为基于 DNA的药物递送载体被研究数 十年,因为它们既能保护包埋的寡核苷酸免受核酸酶降解和肾清除,又能帮助促进细胞摄取和 内涵体逃逸。目前,全球的研究团队已经开发了许多不同的脂质和脂质样结构和制剂方法,产 生了各种各样的 LNP。Patisiran就是依托脂质纳米粒的一款小核酸药物,顺利通过临床Ⅲ期试 验,2018 年成为史上第一个被批准上市的 siRNA药物。
1.4.3 缀合物递送系统(Conjugate Delivery Systems, CDS)
缀合物递送系统,即通过化学键共价连接将小核酸直接连接在具有靶向功能的递送载体上 以实现递送目的,这种系统是明确的单组分系统,仅使用等摩尔量的递送材料和小核酸。第一 个在体内生效的缀合物递送系统由缀合于胆固醇的 siRNA 和其他亲脂性分子组成。还有一些 缀合物递送系统将 siRNA 连接至聚合物,肽,抗体,适体和小分子。全球研发进展处于前沿 的 CDS 主要为 DPC 和 GalNAc 缀合物。
动态多聚缀合物(Dynamic PolyConjugates, DPC)
动态多聚缀合物于 2007 年首次得到报道,是用于响应细胞内环境的 siRNA-聚合缀合物递 送系统的研究成果。这些缀合物包含几个部分,每个部分都在递送过程中发挥特定作用(如 下图所示)。siRNA 通过可水解的二硫键连接到聚合物上;当递送系统处于血液循环中时, 聚合物的活性被 PEG侧链掩盖;通过受体介导的内吞作用诱导靶细胞摄取;PEG在内涵体的 酸性环境中脱落,暴露膜-活性聚合物并触发内涵体逃逸;二硫键在细胞溶胶的还原环境中被 切割,从递送聚合物中释放 siRNA;并且 siRNA本身受到化学修饰,以提高稳定性并减少蛋白质效应。
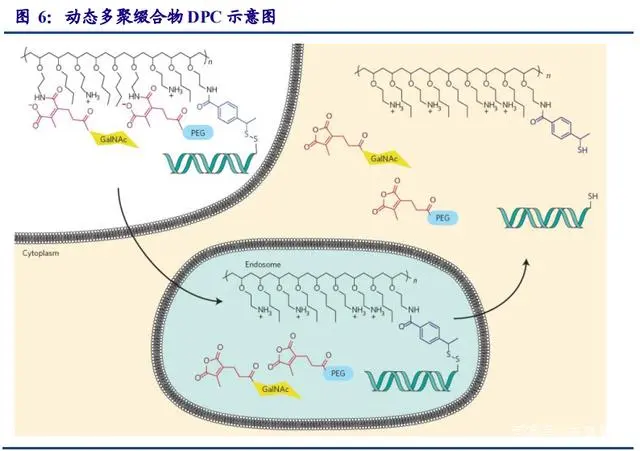
箭头公司(Arrowhead)正在开发新一代的 DPC。原始 PBAVE 聚合物通过不受控制的聚合反应合成,导致尺寸和组成的不均匀性。新一代的 DPC聚合物采用受控自由基聚合法合成,包括原子转移自由基聚合和可逆加成—断裂链转移,生成更优化更合适的均相聚合物。为了减少毒性,可水解的键放在聚合物主链和侧链等不同位置。该公司还报告了通过使用膜活性聚合物和 PEG 屏蔽剂之间更稳定的键,开发了具有更长体内循环的 DPCs。据报道,最新一代的DPCs 在非人灵长类动物体内使用 0.2mg/kg 剂量后,可介导沉默 99%的肝脏靶基因,其药效可持续近 7 周。此外,箭头公司开创性地发明共注射策略用于治疗乙型肝炎,药物名称为ARC-520。可惜的是,该药物因毒性问题暂停于临床Ⅱ期。
三触角乙酰半乳糖胺-siRNA(Triantennary GalNAc-siRNA)
三触角乙酰半乳糖胺-siRNA 是由化学性质稳定的 siRNA 与三价靶向配体组成的肝靶向siRNA缀合物。在该递送系统中,siRNA正义链的 3’末端通过三元间隔子与三个 GalNAc 分子连接。
Alnylam 制药公司正在研究缀合物 ALN-TTRsc,ALN-PCS和 ALN-AT3,分别用于治疗转甲状腺素蛋白淀粉样变性,高胆固醇血症和血友病。Alnylam 的 GalNAc 缀合物使用具有 20-间距的三联体 GalNAc 配体,其以高亲和力与 ASGPR结合。通过将该缀合物皮下和静脉内注射相比较,发现皮下注射会使 siRNA 在肝脏中积累更多,并且沉默靶基因的效果更强因此基于这种缀合物的三种候选药物给药途径均为皮下注射。
ALN-TTRsc 用于沉默甲状腺素运载蛋白(transthyretin,TTR),从而治疗 TTR介导的 淀粉样变性,是 Alnylam 研发的临床上最先进的 GalNAc 缀合物。在非人灵长类动物中,以 2.5mg/kg 的给药剂量每日给药一周后,ALN-TTRsc 皮下注射使循环 TTR 蛋白减少 70%,循 环 TTR mRNA 水平伴随降低。通过每周给予相同剂量的药物可维持这种 TTR 表达水平,在停止治疗后血清 TTR 逐渐恢复到给药前水平。在 300mg/kg的给药剂量下没有观察到明显的细胞 因子诱导,补体活化或其他不良反应的迹象,表明这种药物具有广泛的治疗窗口。已经通过组 织学试验在小鼠中证实预期的治疗表型,外周组织中 TTR 沉积物减少。
其他两种药物也正在研究中,其使用相同的 GalNAc 靶向配体将 siRNA递送至肝脏细胞。 通过改变 siRNA 序列,缀合物已被用于沉默两种循环蛋白的表达:PCSK9,作用于肝细胞对 低密度脂蛋白的摄取;抗凝血酶,其调节凝血酶并在血液凝固中起作用。ALN-PCSsc 是一种 靶向 PCSK9 的缀合物,用于治疗高胆固醇血症,在人源化小鼠中对靶基因的沉默效果表现出 剂量依赖性,半数最大有效浓度(EC50)为 0.3mg/kg。ALN-AT3 靶向抗凝血酶(AT)用于治 疗血友病和罕见出血性疾病。以 1.0mg/kg的给药剂量单次给药后,ALN-AT3 可以使非人灵长 类动物的血清 AT 蛋白水平降低 50%,并且每周剂量低至 0.5mg/kg 使血清 AT 水平稳定降低 75-80%。
目前全球小核酸制药企业,包括 Ionis,Arrowhead, Dicerna, Silence, 以及国内小核酸领军企业瑞博均开发了各自的乙酰半乳糖胺系统。Patisiran据称将是 Alnylam 最后一个基于脂质纳米粒的 siRNA药物,其余均已转向乙酰半乳糖胺递送系统。乙酰半乳糖胺递送系统最大的意义是展示了配体系统递送小核酸的巨大潜力。
二、特异性调控基因表达,小核酸药物堪称优秀的魔法师
狭义的小核酸是指小干扰 RNA(siRNA),而广义的小核酸则包括小干扰 RNA(siRNA)、 反义寡核苷酸(ASO)、信使 RNA(mRNA)、核酸适配体(Aptamer)等。与小分子化学药 和抗体药物不同,小核酸药物由核苷酸组成。目前全球范围内,主要的小核酸药物类别是 ASO、 siRNA、mRNA和 Aptamer。因此在本文中,我们着重对此四类小核酸药物进行分析。
2.1 ASO 反义寡核苷酸类药物
ASO(antisense oligonucleotides,反义寡核苷酸)是一种单链寡核苷酸分子,单链,通常 包含 15-25 个核苷酸。ASO进入细胞后在核糖核酸酶 H1 的作用下通过碱基互补配对原则与其 互补的靶 mRNA结合,抑制靶基因的表达。具体作用机制主要包括
- 与靶基因结合后,招募核糖核酸内切酶 RNAse H,对靶基因进行降解;
- 与 mRNA的起始翻译位点结合,导 致 mRNA无法翻译,从而无法编码蛋白质;
- 与 miRNA结合抑制 miRNA功能;
- 与 pre-mRNA结合,改变剪接体的剪接位置。

目前有八种反义核酸药物已获得监管机构的市场许可上市销售。
Fomivirsen是由美国食品药品监督管理局(FDA)批准销售的首个反义寡核苷酸药物,由 Inois 和诺华合作研发,化学结构为具有硫代磷酸酯键的 21 位碱基的寡核苷酸(在其 5’末端附近包含 CpG基序)。其药效作用为与人巨细胞病毒(CMV)视网膜炎 IE基因的 mRNA互补, 抑制 IE-2 基因在 CMV 感染的细胞的表达,这是病毒复制所必需的基因。该药物物在细胞培 养中显示出比筛选的其他多种硫代磷酸酯寡核苷酸更有效的抗 CMV活性。随后,由于高活性 抗逆转录病毒疗法(HAART)的发展,CMV病例数急剧减少。诺华从 2002 年开始在欧洲和 2006 年在美国停止销售该药物。
Mipomersen(又称为 Kynamro),是治疗纯合子家族性高胆固醇血症(HoFH)的第二代反义寡核苷酸药物,药理作用为抑制载脂蛋白 B(apoB)的合成。给药方式为皮下注射,每 周一次,注射 200 mg。Mipomersen 具有明显的血浆和组织末端消除半衰期,约为 30 天,每 周一次给药约 4-6 个月后即可达到稳态组织浓度。且其药代动力学(PK)特性在所有研究的 物种(包括小鼠,大鼠,猴子和人类)中通常保持一致。临床试验表明,Mipomersen 无论是 作为单一药物还是在最大程度的降脂治疗中,所有测得的含 apoB的动脉粥样硬化脂蛋白均呈 剂量依赖性显著降低。
Inotersen是 2018 年由 FDA批准的第二代反义核酸药物,用于治疗遗传性甲状腺素介导的 淀粉样变性(hATTR),药效为通过 RNase H1 依赖性机制阻止转甲状腺素蛋白(TTR)的产 生。TTR 蛋白主要在肝脏中产生,形成与视网膜结合蛋白 4(RBP4)-视网膜复合物结合的四 聚体,防止其被肾脏清除,并用作几种甲状腺激素转运蛋白之一。运甲状腺素蛋白基因中的常 染色体显性突变导致蛋白质的四聚体形式变得不稳定。单体形成聚集体,沉积在包括周围神经, 心脏组织和肾脏在内的多个组织中。聚集物通常导致周围神经病变,严重的胃肠道功能障碍, 在某些情况下还引起心肌病。遗传性 TTR(hTTR)个体的平均预期寿命从症状发作开始通常 为 3-15 年。实验表明:Inotersen在培养的细胞和转基因小鼠中产生剂量依赖性的 TTR mRNA 和蛋白质减少。在转基因小鼠中,单剂量的 inotersen产生的作用持续 2 至 3 周。施用 Inotersen 的食蟹猴也表现出肝脏中 TTR RNA表达的减少 90%(循环 TTR 蛋白的主要来源),循环 TTR 蛋白减少 80%。治疗耐受性良好,未观察到有害的肝肾功能。
Eteplirsen是 2016 年经 FDA加速审批通过的 ASO药物,用于治疗肌营养不良(DMD), 药理作用为旨在肌营养不良蛋白 pre-mRNA的外显子 51结合并促进外显子 51的跳跃,而 DMD 患者在上游外显子中具有选择突变,略过外显子 51 会产生截短但部分活性的肌营养不良蛋白 产物,从而恢复一定的健康水平。临床研究表明 Eteplirsen通过肌肉内注射到短指伸肌短肌中后 活检组织中的肌营养不良蛋白表达有所增加,高剂量组的样本中肌营养不良蛋白的表达高达正 常肌营养不良蛋白表达的 32%。
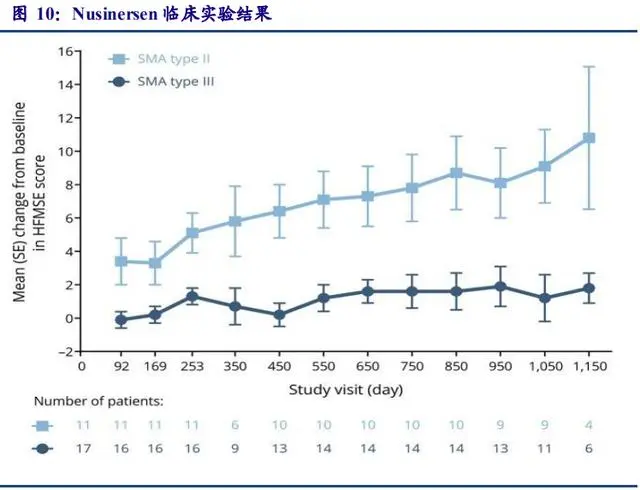
Nusinersen 是用于治疗脊髓性肌萎缩(SMA)的 ASO 类药物,长度为 18 个核苷酸。由 于反义核酸药物不能穿越完整的血脑屏障,因此该药物通过腰椎穿刺髓鞘内注射给药。药理作用为和 SMN2 mRNA的内含子 7 结合促进外显子 7 包涵体的剂量依赖性增加,临床实验中 在表达人 SMN2 的转基因小鼠中增加了 SMN2 蛋白含量。Nusinersen 的初始临床研究针对 2 型和 3型SMA受试者,这可以评估在医学上稳定的患者群体中髓鞘内注射药物的安全性和耐 受性。结果显示:与自然情况相比,给药后观察到运动功能的改善和存活率的提高,以及药 物作用机理的生化证明。上市后 2019 年销售额达 19 亿美元,在商业上取得了成功,证明了 ASO 药物的商业潜力。
Golodirsen 也是用于治疗肌营养不良(DMD)的一种 PMO 修饰的 ASO 药物,专门靶向 肌营养不良蛋白 pre-mRNA的外显子 53,从而将其从最终的 mRNA产品中排除。在具有适当 突变的 DMD患者中,外显子 53的跳过导致 mRNA阅读框的恢复,并导致部分内部缺失的肌 营养不良蛋白的 C 和 N 末端区域完整。大约 7.7%的 DMD 患者具有突变,可以跳过第 53 外 显子来恢复其阅读框架。研究表明,在接受 Golodirsen治疗48 周后,与 25 个 DMD男孩的基 线测量值相比,肌营养不良蛋白的含量有统计学上的显着增加,结果为相对于正常对照组肌营 养不良蛋白的平均百分数为 1.019%(范围 0.09–4.30%),并且平均荧光强度增加。通过免 疫荧光定量的肌营养不良蛋白阳性肌纤维百分比也显示了正确的肌膜定位。
Volanesorsen 是 2019 年由 EMA批准的第二代 2′-MOE 修饰反义核酸药物。用于治疗家 族性高乳糜微粒血症(FCS)。它选择性地结合在载脂蛋白 apoC3 mRNA的 3’非翻译区域(在 489-508 的碱基位置)内。这种结合可防止 apoC3 mRNA的翻译,并允许核糖核酸酶 H1 介导 的 mRNA 降解,从而通过 LLP 依赖性途径促进甘油三酸酯清除并降低血浆甘油三酸酯水平。 这些途径包括 apoC3 抑制由 LDLR 和 LRP1 介导的肝受体介导的途径。实验结果显示: Volanesorsen在人肝癌细胞系和原代人肝细胞中以浓度依赖的方式选择性降低 apoC3 mRNA含 量。施用 Volanesorsen 与血浆中 apoC3 蛋白的剂量依赖性降低和甘油三酯(TG)水平的平行 降低呈现统计学相关。
Casimersen(AMONDYS 45)是 2021 年刚由 FDA批准的治疗杜氏肌营养不良症(DMD) 的 ASO 药物。该药利用 Sarepta 专有的磷酸二酰胺吗啉代寡聚体(PMO)化学和外显子跳过 技术,跳过 DMD 基因的第 45 号外显子,允许产生一个内部截短的肌营养不良蛋白,从而治 疗 51 外显子跳跃突变 DMD患者(占 DMD人群的 13%)。临床实验结果显示,通过蛋白免疫印 迹检测,Casimersen组患者在接受治疗 48 周后,平均抗肌萎缩蛋白水平由基线的 0.925%上升 至 1.736%(p<0.001)。同时,AMONDYS 45 组患者的抗肌萎缩蛋白水平显著高于安慰剂组 (p=0.009)。
Alicaforsen 是由 Atlantic Healthcare 开发的用于治疗慢性结肠袋炎的 ASO 药物,处于 III 期临床实验。慢性结肠袋炎是在手术并发症或溃疡性结肠炎期间在结肠袋内层引起的炎症。炎 症反应中 ICAM-1(细胞表面受体细胞间粘附分子 1)可将循环中的白细胞引导至炎症部位, 并增加结肠袋炎的炎症反应。而 Alicaforsen可与 ICAM-1 mRNA杂交并降低其水平。在临床 试验中,Alicaforsen治疗可减少炎症和大便次数,从而改善生活质量。内窥镜检查也显示了下 层组织的改善。
Tominersen(RG6042)是由 Ionis Pharmaceuticals 开发的用于治疗亨廷顿病的 ASO药物, 正处于临床 III 期研究。亨廷顿病(HD)是一种常染色体显性遗传的进行性神经退行性疾病, 病理表现为肌张力障碍,认知功能障碍和行为障碍。致病机理为相关基因 CAG 三核苷酸重复 扩增导致亨廷顿(mHTT)蛋白质具有延伸的聚谷氨酰胺束,相关 mHTT在神经元中积累最终 会影响其正常功能。Tominersen 可用于靶向 mHTT mRNA 以防止蛋白质产生。在 46例早期 HD 患者中评估的 I和 II期临床试验中,证明了 Tominersen具有改变疾病的潜力。患者接受鞘 内注射三个月的每月剂量的 Tominersen(10、30、60、90、120 mg)或安慰剂。以 90 和 120 mg 的剂量在脑脊液中观察到 mHTT蛋白平均降低 40%。该候选药物在患者中显示出良好的耐受 性,并且在高剂量下无不良反应。
Tofersen 是一种用于治疗家族性肌萎缩性侧索硬化症(ALS)的在研 ASO 药物,处于临 床 III 期研究。超氧化物歧化酶(SOD1)酶在清除体内产生的自由基方面起着至关重要的作 用。SOD1 基因的突变导致功能异常的 SOD1 的产生,该 SOD1 以毒性蛋白的形式积累在细胞 中,并导致家族性肌萎缩性侧索硬化症(ALS)。而 Tofersen可用于靶向突变的 SOD1 mRNA, 以防止蛋白质产生,从而减慢 ALS的进展。一项 I和 II期双盲,随机,安慰剂对照试验显示, Tofersen治疗组的机能障碍性脑脊髓液 SOD1 浓度降低。与安慰剂对照相比,Tofersen治疗还 可以改善呼吸和肌肉功能。Tofersen由 Biogen开发,目前正在进行 III 期试验,以检查 Tofersen在 SOD1-ALS 患者中的临床疗效。
2.2 siRNA 小干扰核酸类药物
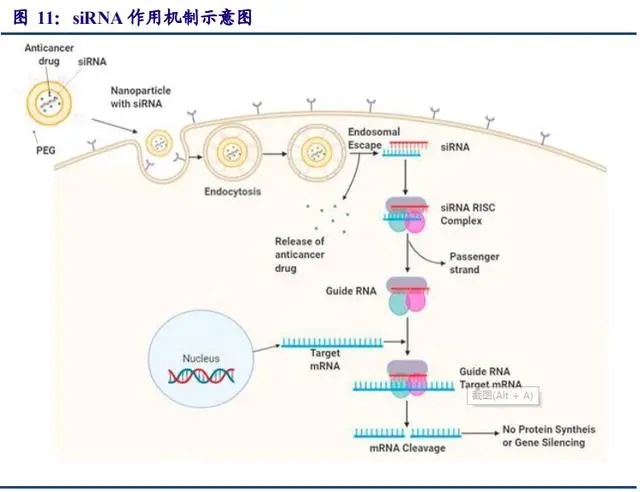
siRNA是一种长约 21-23 个碱基对的双链 RNA,在细胞核中转录后,双链 siRNA以及相 关的蛋白质便会穿过核孔,并在核孔中由 RNase III 核酸酶裂解形成单链 siRNA,导致在 3’端 的两个核苷酸突出和在 5’端的单磷酸突出。如此形成的单链 siRNA与 Ago 等蛋白质结合,降解双链 siRNA的过客链(即有义链)并掺入引导链(即反义链),此链用于和互补 mRNA的 识别,并作为切割的模板,形成的蛋白复合物称为沉默效应复合物(RISC)。基因沉默时, 引导链保持附着于 RISC,并将复合物引导至靶 mRNA。在正确识别与引导 RNA互补的 mRNA 核苷酸序列后,切割过程通过在引导 RNA的 5’一磷酸末端上游切割 10至 11个核苷酸的 mRNA 来实现。该过程借助酶 Ago2 催化,该酶是 RISC的最重要组成部分之一。切割后的 mRNA无 法继续完成原有的生物学功能,从而完成沉默。
Patisiran 是第一种由 FDA批准的 siRNA药物。用于治疗遗传性 ATTR(hATTR)淀粉样 变性病,经过 2’MOE化学修饰,以脂质纳米颗粒(LNP)靶向递送至肝细胞 TTR mRNA。 临床 I期研究显示,在 0.15、0.3 和 0.5 mg / kg 剂量的 Patisiran静脉内输下,血浆 TTR蛋白的 浓度呈现剂量依赖性降低。输注后约 7 天出现最大程度的减少(> 80%的几何平均值),并且 效果持续了一个多月。
Givosiran是 2019年 11月 FDA批准的第二种 siRNA药物。由 Alnylam研发(开发 Patisiran 的同一家公司),用于治疗成人急性肝卟啉症,皮下给药且耐受性良好。与有义链结合的 GalNAc 促进了肝细胞的吸收。进入肝细胞后,它与氨基乙酰丙酸合酶 1(ALAS1)mRNA结合并使其 沉默。
Lumasiran是一种皮下注射的 siRNA药物,由 Alnylam 公司开发,用于治疗 1 型原发性高 草酸尿症(PH1)。草酸是与 PH1 临床表现直接相关的有毒代谢产物,Lumasiran的药效原理 为靶向羟酸氧化酶 1 基因(HAO1; 编码乙醇酸氧化酶),通过使编码乙醇酸氧化酶的基因沉 默,阻断乙醇酸氧化酶的合成,从而抑制了草酸的合成。2020 年 11 月 19 日,Lumasiran在欧 盟获得了首个全球批准,用于治疗所有年龄段的 PH1。2020 年 11 月 23 日,Lumasiran在美国 获准用于治疗患有 PH1 的成人和儿童。
Inclisiran是针对 PCSK9 蛋白的长效皮下递送 siRNA药物,与 GalNAc 缀合递送。GalNAc 可与肝脏大量表达的去唾液酸糖蛋白受体结合,导致药物特异性地被肝细胞摄取。Inclisiran 通过硫代磷酸酯(PS),2'- MOE和 2'-F组合修饰,以提高分子稳定性。在涉及非人类灵长类 动物的临床前研究中,每公斤体重 3 mg以上的剂量可使血浆 PCSK9 水平降低 80%以上,并 使血清 LDL胆固醇水平降低约 60%,峰值作用持续超过 30 天后,在给药后 90 到 120 天内非 常缓慢地恢复到基线水平。这项 1 期研究评估了 LCL胆固醇水平至少为 100 mg / dl(2.60 mmol / l)的健康志愿者单次或多次皮下给予 Inclisiran 的安全性,副作用和药效学作用少数参与者 服用稳定剂量的他汀类药物联合疗法。
QPI-1002 是一种由 Quark Pharmaceuticals 研发的 siRNA药物,正处于 III期临床实验,可 抑制促凋亡蛋白 p53 的表达,主要用于预防初次心血管手术后的急性肾损伤(AKI),以及预 防已故的供体肾移植后的延迟移植功能(DGF)。AKI 是一种临床上压倒性疾病,导致大约 5 %的住院人数,并且据记录,在 AKI术后 30 天内,死亡率超过 50%。 DGF也是肾移植后立 即发生的最普遍的并发症之一,影响了 25%–40%的死者供肾移植患者。QPI-1002 已被美国食 品和药物管理局(FDA)和欧洲药品管理局(EMA)授予在肾脏移植中预防 DGF的孤儿药称 号。在 2010 年 8 月,夸克与诺华(Novartis)签署了该药物所有适应症的独家许可协议。
Fitusiran 是 Alnylam Pharmaceuticals 开发的用于治疗血友病的 siRNA的药物,处于 III 期 临床实验阶段。血友病是由于凝血因子 VIII 或 IX缺乏引起的 X连锁出血性疾病。而 Fitusiran 的作用是抑制肝脏中的抗血栓(AT)mRNA。在 II 期临床试验中,每月对 25 名 A和 B 型血 友病患者给予 Fitusiran(50 mg)。实验显示,81%的 AT mRNA敲低对应于出血频率降低 49-100 %。用 Fitusiran 治疗 13 个月后,患者的年化出血率(ABR)从 12 提高到 1.7 。
2.3 Aptamer 核酸适配体类药物
核酸适配体(Aptamer)是折叠成独特的三维结构的短单链寡核苷酸。可利用其三维 结构特异性结合较大范围的目标,包括蛋白质,小分子,金属离子,病毒,细菌和全细胞, 其高特异性和结合亲和力可达到抗体水平。与抗体相比,核酸适配体具有许多优势,例如 体外筛选快速,可无细胞化学合成,以及体积小,具有较低免疫原性和较强组织穿透力。

Aptamer 的制备通常采用指数富集的配体选择性进化(SELEX)技术。SELEX 通常 分为四个步骤:孵育,分配,回收和扩增。首先通过将初始 DNA 或 RNA 文库与目标靶 标混合而开始。一个文库通常包含最多 20–60 个核苷酸的随机序列。孵育后,靶标结合 的序列通过各种分配策略与未结合的序列分离。回收结合靶标的序列后再扩增以产生用于 随后选择循环的新文库。新的 DNA文库可通过 PCR 直接扩增,而回收的 RNA序列必须 在 PCR 扩增之前逆转录为 cDNA,并在下一个周期转录成新的 RNA文库。选择循环重复 2 至 15 次后,可使用测序分析来鉴定已在文库中富集的特定序列。为了增强目标结合序 列的富集,还可以在选择周期内通过操纵文库与目标的比例来提高选择严格性。
Pegaptanib 是目前唯一获批的 Aptamer 药物。它是一种具有 29 个核苷酸的 RNA适 配体,5’末端包括一个 40kD 聚乙二醇部分,可延长组织停留时间。药理作用为抑制血管 内皮生长因子(VEGF)165,后者主要负责病理性眼部新血管形成和血管通透性,同时 保留了同工型 VEGF 121 的活性。经过十多年的发展和临床前研究,Pegaptanib 在临床试 验中显示可有效治疗与年龄相关性黄斑变性相关的脉络膜新生血管。在接受长达三年的治 疗的患者中也证实了其出色的眼部和全身安全性。对照良好的研究进一步表明,Pegaptanib 在人血浆中稳定超过 18h,而在猴子中,单次给药后 4 周在玻璃体内检测到 Pegaptanib 进入玻璃体。
目前还有诸多 Aptamer 产品处于临床研究阶段。
Zimura(ARC-1905)是聚乙二醇(PEG)修饰的单链寡核苷酸 Aptamer 药物,可靶 向并抑制补体因子 C5。而补体级联反应中对 C5的抑制可防止关键末端片段(C5a和 C5b-9)的形成。补体 C5b-9 参与 MAC 过程,通过细胞膜的破坏引起细胞死亡的形成。IIa 期临 床试验中对 65 例先前未曾使用抗血管内皮因子(VEGF)药物的湿性 AMD 患者进行了玻 璃体内联合 0.5 mg Ranibizumab 施用 Zimura 的安全性研究。与接受 Ranibizumab 单抗单 药治疗的患者相比,接受 Ranibizumab 单抗-Zimura 联合治疗的患者视力得到改善的百分 比更高。
REG1 是一种由 Regado Biosciences 开发的抗凝系统,目前处于 II 期临床试验中。包 括 RB006,凝血因子 IXa 特异性适体及其寡核苷酸解毒剂 RB007。REG1 目前正在通过临 床实验评估为可逆性抗凝剂,用于经皮冠状动脉介入治疗。RB007 是完全 2' - O-甲基取代 的 17-mer 寡核苷酸,其与 RB006 的 5'-末端区域互补。而 RB007 则快速破坏 RB006 的结 构并抑制其抗凝功能。临床实验显示并静脉内给药后体内抗凝作用迅速开始,然后在服用 RB007 解毒剂 78 后迅速恢复至基线水平。
2.4 mRNA 信使核酸类药物
mRNA 是机体内指导蛋白质合成的基础性 RNA 分子,理论上外源 mRNA 可补充相关蛋 白的含量,从而治疗特定的疾病。这种概念可以追溯到 1978 年,当时的第一个尝试是使用脂 质体将兔珠蛋白 mRNA递送至小鼠淋巴细胞并产生功能性蛋白质(Dimitriadis,1978)。然而, 在接下来的十年中,由于不稳定性,细胞渗透性差,免疫原性以及生产成本高等诸多问题, mRNA 并未被用作治疗剂。自 1990 年代以来,随着核酸化学的研究的推进和 mRNA 生产成 本的持续下降,mRNA 被用作潜在的免疫治疗剂。早期临床试验是用编码肿瘤特异性抗原的 mRNA转染树突状细胞(DC),以刺激细胞毒性 T淋巴细胞抵抗癌症,例如转移性前列腺肿 瘤。在过去的十年中,由于基于 mRNA 的治疗方法具有以下优点,其应用已扩展到应对多种 疾病和病症:
- mRNA 不会修饰宿主的基因,从而避免了基因毒性。
- 可以以相对受 控的方式递送 mRNA 以调节转染效率和蛋白质表达的持续时间。
- mRNA 的传递不需要 核定位或转录。另外,mRNA 特别适合瞬时蛋白质表达,例如基因组编辑,以最大程度地减 少脱靶效应。所有这些优点使得众多药企认为 mRNA 是一类潜在的新型治疗剂,可用于治疗 遗传性疾病,癌症,传染病,心血管疾病等病症。

mRNA疗法主要包括:
- 通过外源导入 mRNA来纠正基因表达缺陷或异常;
- 将表达抗原蛋白的 mRNA制成疫苗。
目前 mRNA应用主要集中在疫苗领域,优势体现在其设计速度快,低蛋白水平就可激发 人体免疫反应。且一条 mRNA可以联合用药编码多个蛋白,成本较重组蛋白更低。
新冠肺炎疫情期间 mRNA 疫苗的研发与临床实验得到了全世界的关注,比较具有代表性 的是 Moderna 公司的 mRNA-1273 疫苗。该疫苗是一种脂质纳米颗粒(LNP)包裹的,基于 mRNA 的疫苗,可编码引起 Covid-19 疫情的 SARS-CoV-2 病毒的预融合稳定全长刺突蛋白, 注射入人体后可引起相应的免疫反应。临床实验表明,mRNA-1273 疫苗在预防 Covid-19 疾病 (包括严重疾病)方面显示出 94.1%的功效。除了短暂的局部和全身反应外,未发现安全隐患, 药效优秀。 除了在疫苗领域的应用,还有一些外源 mRNA补充蛋白疗法处于临床研究中。
BNT111 是由 BioNTech公司开发的 mRNA药物,处于 I期临床实验,用于治疗转移性肿 瘤患者的晚期黑色素瘤,并作为肿瘤切除后的辅助治疗。它旨在引发对四种黑素瘤相关抗原的 免疫反应。首次人体剂量递增研究(MERIT 研究)评估了晚期黑色素瘤患者结内给药的安全 性和耐受性,表明该药物经过优化可诱导针对恶性黑色素瘤靶抗原的抗原特异性 CD8+和 CD4+ T细胞应答。
CV8102 是一种基于非编码单链 RNA的 TLR7 / 8 / RIG-1 激动剂,旨在调节肿瘤内注射后 的肿瘤微环境,并诱导全身免疫反应,以控制注射和未注射的远处病变。目前正在对 CV8102 进行公开的 I期临床剂量递增和扩大研究,其中包括晚期黑色素瘤,皮肤鳞状细胞癌,头颈部 鳞状细胞癌或腺样囊性癌以及浅表可注射的肿瘤病变。
三、小核酸产业化步入新纪元,有望成为小分子与单抗之后第三大类药物
3.1 政策持续鼓励创新研发,小核酸药物列入重点发展领域
基因治疗与小核酸药物列为政策重点扶持领域。国际层面,FDA 相继发布 6 大指南推进 基因疗法开发,包括血友病、视网膜疾病和罕见病的人类基因治疗指南,以及 3 个基因疗法的 指南更新。目前 FDA已经审批通过 13 个小核酸药物上市,扶持力度可见一斑。国内层面,近 年来我国大力鼓励创新研发,优先审评审批、药品上市许可人等重磅政策频出,基因治疗与小 核酸药物被列出重点扶持领域。
3.2 小核酸优势明显,适应症范围广,应用潜力大
与小分子和单抗药物相比,小核酸药物具有明显优势。小核酸药物通过上/下调靶基因的 表达,从而实现疾病治疗的目的,我们认为,小核酸药物具有如下几方面优势。(
- 候选靶 点丰富。小分子药物与抗体类药物靶点多为蛋白质,包括激酶、受体、抗原等,而人类疾病相 关的致病蛋白约 80%不能被目前常规的小分子药物与生物大分子制剂所靶向,属于不可成药 蛋白。同时,人类基因组中,只有 1.5%的基因序列编码蛋白质,和疾病相关的蛋白只占其中10-15%。而小核酸药物作用于靶基因,因此能针对难以成药的蛋白靶点实现突破,极大地扩 展靶点的作用范围。在小分子与抗体药物不可靶向、难以成药的疾病领域具有巨大的应用潜力。
2.设计简便。小核酸药物的数字化设计使其早期研发速度远远快于其他种类药物。不同于 小分子药物开发需要大规模化合物筛选,小核酸药物只需要锁定致病基因序列,并针对该基因 序列进行设计及相应 RNA 片段的合成,继而开展候选化合物筛选和验证。(
-
强特异性。 通过碱基互补配对以序列特异性的方式结合到靶基因 mRNA,使得小核酸药物具有精准、高 效的效果。
-
药效持久。经稳定化修饰的小核酸药物通过调控 mRNA 抑制相关蛋白的表 达,疗效持久,可实现更少的给药频次。在部分适应症中,小核酸药物已可实现半年一次的给 药频率,大幅提高患者依从性,这一特点对很多疾病尤其是慢病的治疗具有巨大的临床价值。
-
临床开发成功率高。小核酸药物通过测定基因序列锁定疾病基因,针对性设计避免了研 发过程的盲目性,在研发成功率上达到了突破性的变革,以 Alnylam 为例,其研发项目从Ⅰ 期临床进展到Ⅲ期临床开发成功率达到 59.2%,远高于制药行业平均 5.5%的临床开发成功率。
候选靶点丰富,适应症范围广,应用潜力大。小核酸药物从转录后水平治疗,候选靶点 丰富,特别针对一些蛋白靶点难以成药的基因,未来适应症范围广,应用潜力大。根据《RNA therapeutics on the rise》(Nature Reviews Drug Discovery 19, 441-442, 2020),分析全球 431 个小核酸药物在研项目,其中,63%处于 pre-IND阶段,32%处于早期临床阶段(Ⅰ期或Ⅱ期), 3%处于Ⅲ期。研究项目覆盖多个疾病治疗领域,主要包括抗肿瘤、神经系统疾病、心脑血管、 代谢疾病、传染病、眼科疾病等。值得一提的是,小核酸疗法在治疗罕见病,尤其是神经系统 和肝脏疾病方面取得了巨大成功。在 21种处于研发后期的小核酸药物中,18种为罕见病用药。
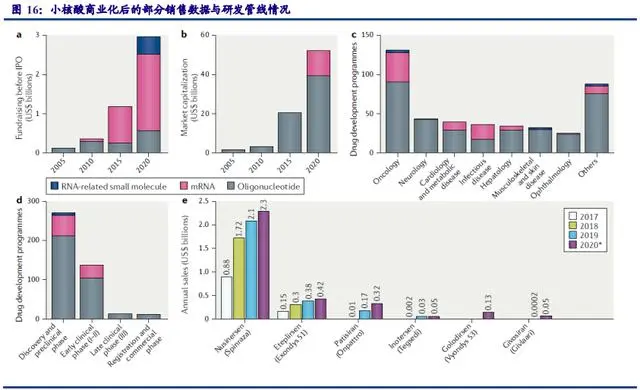
上市药品销售业绩出色。产品端来看,获批上市的小核酸药物取得了出色的销售业绩。 具代表性的是由 Ionis 公司研发的用于治疗脊髓性肌萎缩症(SMA)的药物 Nusinersen,上市后 到 2020 年前该药物总共产生了 47 亿美元的销售收入。此外由 Alnylam 研发的用于治疗遗传 性转甲状腺素蛋白淀粉样变性的药物 Patisiran 在上市后第一年 2019 年也取得了 1.5 亿美元 的不错销售成绩,预计 2020 年销售额将翻一番。
小核酸药物逐渐步入快速发展期,预计 2024 年全球市场规模超过 80 亿美元。随着化学 修饰与递送技术不断突破,小核酸产业化瓶颈问题逐渐得以解决,行业步入快速发展期,2019 年全球市场规模已达 19.19 亿美元。根据 Evaluate Pharma和 BCG分析,2024 年全球小核酸市 场规模将会达到 86 亿美元,预计 2018 年-2024 年 CAGR 将达到 35%。
3.3 资本追捧,加快小核酸产业化进程
技术突破与新产品获批为小核酸产业化注入极大信心,资本追捧加快小核酸产业化进程。
随着核酸修饰和递送技术的突破,曾经因技术瓶颈选择退出的资本重拾信心入场。2019 年, 制药巨头罗氏斥资共 16.7 亿美元获得了治疗慢性乙肝的药物 Dicerna的权益,该药尚处 I期临 床研究;辉瑞则以 15.5 亿美元获得了治疗心血管和代谢性疾病的药物 Akcea 的权益。2020 年 4 月 16 日,mRNA药物巨头 Moderna与美国生物医学高级研究与开发局(BARDA)达成协议, 将获得最高 4.83 亿美元的资金支持,拟用于测试和生产 mRNA-1273 疫苗;其曾以 6.04 亿美 元的募资创下了生物科技公司规模最大的 IPO纪录。资本巨头黑石更是于 20 年 4 月斥巨资 20 亿美元支持 Alnylam 的 RNAi 项目,成为 biotech 行业领域最大的单笔私有投资案例。
国内小核酸制药领域经过不断发展亦逐渐受到资本青睐。2020 年国内小核酸制药领军企 业瑞博生物获得了 4.7 亿元人民币的 C2 轮融资支持,由中国国有资本风险投资基金领投,中 金启德基金、高瓴创投联合领投,恒旭资本、朗玛峰创投、上海自贸区基金和弘陶资本等知名 投资机构共同跟投。本轮募集的资金拟用于支持瑞博生物在研品种的研发,促进其研发管线末 端产品早日落地产生销售收入。在此之前,公司先后获得 1.25 亿元的 A轮融资、2.7 亿元的 B 轮融资和 2.03 亿元的 C1 轮融资。目前,公司正在筹备科创板上市。
精选报告来源:【未来智库官网】
参考资料
